Аспартатаминотансфераза (АсАТ) и аланинаминотрансфераза (АлАТ) – близкие по действию ферменты, при участии которых в организме человека осуществляется межмолекулярный перенос аминогрупп с аминокислот на кетокислоты. Этот процесс называется переаминированием. Значение переаминирования состоит в синтезе и разрушении отдельных аминокислот в организме.
Аминотрансферазы (АсАТ и АлАТ) являются внутриклеточными ферментами и их содержание в сыворотке крови здоровых людей невелико. Однако при повреждении или разрушении клеток, содержащих АсАТ и АлАТ (клеток печени, мышц сердца, скелетной мускулатуры и почек) происходит дополнительный выброс этих ферментов в кровяное русло, что приводит к повышению их активности в крови.
Максимальное количество АлАТ содержится в печени. При поражении клеток печени вирусами, различными химическими веществами, в т.ч. алкоголем и лекарствами, а также при нарушении оттока желчи из-за сдавливания желчного протока или его закупорке камнями активность АлАТ в крови возрастает. Поэтому определение активности фермента в сыворотке крови широко используется для диагностики болезней печени. Степень увеличения активности АлАТ, как правило, пропорциональна тяжести заболевания, в острых случаях активность фермента в сыворотке крови может превышать нормальные значения в 5-10 раз. При инфекционном гепатите повышение активности фермента происходит в очень ранние сроки. С увеличением сроков заболевания активность фермента обычно снижается, но медленно, в течение нескольких месяцев – при легком течении заболевания. Резкое увеличение активности АлАТ наблюдается и при безжелтушной форме заболевания, поэтому данный тест широко применяется при обследовании лиц, пребывающих в очаге инфекции. Исследование активности АлАТ обязательно для всех доноров крови для исключения хронических заболеваний печени.
Длительно продолжающееся увеличение активности трансаминаз или повышение в поздние сроки заболевания может означать развитие массивного развитие некроза печени. Высокая активность АсАТ, превышающая активность АлАТ, предполагает обширный некроз и плохой прогноз (это происходит за счет митохондриальной АсАТ).
При рецидивах и обострении активность фермента вновь повышается. Активность АсАТ при этом также повышается, но значительно ниже, чем АлАТ. Коэффициент АсАТ/АлАТ
95.83.20.14 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
По материалам studopedia.ru
Диагностическое значение изоферментов ЛДГ
Изоферменты ЛДГ и их диагностическое значение
Активность ЛДГ возрастает также при хронических лимфогранулематозах, лейкозах, пернициозной анемии и других заболеваниях
Клиническое значение определения активности ЛДГ сыворотки крови
Определяют спектрофотометрическими и колориметрическими методами.
ЛДГ— гликолитический фермент, обратимо катализирующий окисление лактата в пировиноградную кислоту.
L-лактат + НАД ↔ пируват + НАДФ + Н +
Активность в тканях: практически во всех органах, нааибольшая активность в почках, сердечной мышце, скелетной мускулатуре и печени. Много в эритроцитах.
Требования к материалу: полное отсутствие гемолиза (ЛДГ в эритроцитах ↑ в 100 раз, чем в сыворотке).
Норма в сыворотке – до 195 МЕ (при 25 0 С).
Инфаркт миокарда. ↑ЛДГ спустя несколько часов после ИМ , max через 36_48 ч (в 10—15 раз по сравнению с нормой). У больных стенокардией не повышается. Диагностическая точность при трансмуральном инфаркте 97±1,7% .
Заболевания печени. ↑ЛДГ в сыворотке при поврежедении целостности гепатоцитов- паренхиматозная желтуха. При механической желтухе в начале заболевания активность ЛДГ в норме, а на более поздних стадиях ↑ ЛДГ.
Прогрессирующая мышечная дистрофия ↑ЛДГ
Активность изоферментов ЛДГ в сыворотке крови в порядке убывания: ЛДГ2 > ЛДГ1 > ЛДГ3 > ЛДГ4 > ЛДГ5.
Изоферменты ЛДГ в лейкоцитах в норме: ЛДГ3 > ЛДГ2, > ЛДГ4 > ЛДГ1 > ЛДГ5.
Инфаркт миокарда: ↑↑↑ ЛДГ1, ↑ ЛДГ2. ЛДГ1/ЛДГ2 > 1. Изменения в активности изоферментов сохраняются дольше, чем суммарной активности фермента. При неясной клинической картине и нормальной общей активности ЛДГ повышение активности ЛДГ1 указывает на мелкие некротические очаги в миокарде, не регистрируемые другими способами.
Паренхиматозная желтуха: ↑↑↑ ЛДГ5 и ЛДГ4, ↓ЛДГ1 и ЛДГ2.
Мышечные дистрофии: в мышечной ткани ↓↓ЛДГ4 и ЛДГ5 (степень снижения коррелирует с тяжестью заболевания), ↑↑ ЛДГ1, ЛДГ2, и ЛДГ3. В сыворотке крови ↑↑ ЛДГ1, ЛДГ2 и ЛДГ3.
Острый лейкоз: ↑↑↑ ЛДГ2, ↑ЛДГ3 . Прямо пропорциональная зависимость между увеличением ЛДГ2 и количеством незрелых клеток.
Опухолевые заболевания: ↑↑ ЛДГ3 ЛДГ4 и ЛДГ5 в опухолевой (приближение к эмбриональному типу). Различия между злокачественными и доброкачественными максимальны по ЛДГ5. Степень изменения спектра изоферментов коррелирует с ростом опухоли.
Заболевания легких: ↑↑ ЛДГ3 при пневмониях. При выраженной гипоксии ↑ЛДГ4 и ЛДГ5 (активация гликолиза в связи с перестройкой метаболизма на анаэробный тип).
Трансаминазы –(аминотрансферазы) АлАТ и АсАТ катализируют процессы переаминирования, т.е. обратимого переноса аминогруппы (– NH2) от АК на кетокислоту, с образованием новой АК.
АсАТ катализирует реакцию:
e NYtFU/xE8kVZdUoIaZD/k46L8u90crlRZwVelXxtVPYaPXUUyD69E+k0dpz0WTNbK04bj9WhAkC6 KfhyzfBuvNynqOefwfwXAAAA//8DAFBLAwQUAAYACAAAACEArUze1t8AAAAJAQAADwAAAGRycy9k b3ducmV2LnhtbEyPwU7DMAyG70i8Q2QkbiztVCpamk4IgcQJwYaQuGWNacsapyTZWnh6PHGAo+1P v7+/Ws12EAf0oXekIF0kIJAaZ3pqFbxs7i+uQISoyejBESr4wgCr+vSk0qVxEz3jYR1bwSEUSq2g i3EspQxNh1aHhRuR+PbuvNWRR99K4/XE4XaQyyTJpdU98YdOj3jbYbNb762CYjNduie/e83S/vPt ++4jjg+PUanzs/nmGkTEOf7BcNRndajZaev2ZIIYFGRpkjGqYFnkIBjIipy7bH8Xsq7k/wb1DwAA AP//AwBQSwECLQAUAAYACAAAACEAtoM4kv4AAADhAQAAEwAAAAAAAAAAAAAAAAAAAAAAW0NvbnRl bnRfVHlwZXNdLnhtbFBLAQItABQABgAIAAAAIQA4/SH/1gAAAJQBAAALAAAAAAAAAAAAAAAAAC8B AABfcmVscy8ucmVsc1BLAQItABQABgAIAAAAIQCkRbQbMAIAAFQEAAAOAAAAAAAAAAAAAAAAAC4C AABkcnMvZTJvRG9jLnhtbFBLAQItABQABgAIAAAAIQCtTN7W3wAAAAkBAAAPAAAAAAAAAAAAAAAA AIoEAABkcnMvZG93bnJldi54bWxQSwUGAAAAAAQABADzAAAAlgUAAAAA » o:allowincell=»f»> Аспарагиновая кислота + Глютаминовая кислота + ЩУК
АлАТ катализирует реакцию:
L-аланин +L-кетоглутаровая Глютаминовая кислота + ПК
Отличаются по названиям аминокислоты, от которой отщепляется аминогруппа. Поскольку в названии фермента присутствует аминокислота аланин, это означает, что данный фермент переносит именно аминокислоту аланин. Коферментом АСТ является витамин В6. АЛТ синтезируется в клетках, поэтому в норме его активность в крови невысока.
Коферментом АСТявляется витамин В6. АСТ является внутриклеточным ферментом, то есть в норме находиться в клетках. В клетках фермент может присутствовать в цитоплазме и митохондриях.
Процесс переаминирования был открыт русскими учёными Крицман и Браунштейн (муж и жена) в 1937 году. Впервые в 1954 году Врублевский и Карман обнаружили подъем АсАТ в сыворотке крови у больного с острым инфарктом миокарда. Причем повышение активности фермента наблюдалось через 4 – 6 часов, держалось весь острый период и спадало при начале рубцева-ния; Было замечено, что чем больше очаг поражения, тем выше активность АсАТ.
Содержание АсАТ в тканях (по убывающей) – сердечная мышца, печень, скелетная мускулатура, головной мозг, почки, семенники. Активность в сердечной мышце в 10000 раз выше, чем в сыворотке. В эритроцитах – в 10 раз больше, чем в сыворотке. Поэтому сыворотка не должна содержать даже следов гемолиза.
Содержание АлАТ в тканях (по убывающей)– печень, поджелудочная, сердце, скелетная мускулатура.
Норма в сыворотке: АсАТ — 10-30 МЕ/л при 30˚С; АлАТ — 7-40 МЕ/л при 30˚С.
Снижение активности беременности и др АсАТ, АлАТ наблюдается при:
— снижение в организме Vit B6 (т.к. это кофермент)
Методы определения: спектрофотометрические, колориметрические, хроматографические.
Диагностическое значение определения АсАТ и АлАТ в сыворотке
Инфаркт миокарда ↑↑↑ АсАТ (в 2-20 раз), ↑↑ АлАТ в 98% случаев. Ч/з 6-12 час., максимум – 24-48 часов, нормализация ч/з 4-5 дней. Степень повышения коррелирует с прогнозом. При стенокардии– в норме.
Заболевания печени: ↑↑↑ АлАТ, ↑ АсАТ при поражении гепатоцитов. Максимум на 6-10 день, нормализуется на 15-20 день. ↑↑↑ АлАТ отмечается рано (уже в инкубационом периоде) и даже при безжелтушных формах.
Снижение АсАТ и АлАТ — при недостаточности пиридоксина (витамина В6), процедуры гемодиализа; ХПН, Беременность.
Коэффициент де — Ритиса — это отношение АсАт/АлАТ, который в сердце здорового человека равен 1,33. Увеличение коэффициента де Ритиса выше 1,3 характерно для инфаркта миокарда, и снижение его ниже 1,3 – выявляется при заболеваниях печени.
Поэтому определение активности данных ферментов используется для ранней диагностики заболеваний (определение активности АлАТ в дожелтушный период при паренхиматозной желтухе назначается всем контактным), а также для дифференциальной диагностики: (при паренхима-тозной желтухе активность АлАТ, АсАТ выше нормы, при механической – в норме).
Коэффициент Шмидта: для дифференциальной диагностики заболеваний печени — АсАТ + АлАТ /ГлДГ (глютамат дегидрогеназа). При паренхиматозном гепатите ГлДГ меняется незначительно, а при механических желтухах – ↑↑↑ ГлДГ, но АсАТ + АлАТ ↑
α- амилаза сыворотки и мочи
Гидролазы, катализирующие гидролиз полисахаридов. В плазме амилаза двух изоэнзимных типов — панкреатическая – Р-тип (составляет 40%) и слюнная – S-тип (60%). С мочой выделяется в основном Р-тип.
Норма в сыворотке 16-30 г/ч х л, в моче – до 160 г/ч х л.
Клиническое значение определения α- амилазы
Ø Диагностика заболеваний поджелудочной железы (особенно уроамилаза в суточной моче). При о. панкреатите амилаза крови и мочи ↑↑↑ через 4-6 часов от начала заболевания, максимум 12-24 часа (в 10-30 раз), затем быстро снижается и приходит к норме на 2-6 день. Диагностическая чувствительность амилазы сыворотки для острого панкреатита – 95%, специфичность – 88%. Уровень повышения сывороточной амилазы не коррелирует с тяжестью панкреатита.
Ø Дополнительный диагностический признак при о. почечной недостаточности с олигурией, прободной язве, диабетическом кетоацидозе (↑ в 5-10 раз);
ХПН, паротит — ↑ менее чем в 5 раз
По материалам studopedia.su
Трансаминазы — ACT и АЛТ — обладают весьма низкой специфичностью и чувствительностью в диагностике ИМ и не рекомендуются к использованию как маркеры ИМ. К примеру, рост ACT часто выявляется и при поражениях печени, и при панкреатитах, и при ТЭЛА, после приема больших доз алкоголя, после внутримышечного введения ЛС. Определение трансаминаз — дешевый метод, но требуется выполнять такие правила: анализ крови должен быть сделан в течение первых 6 ч, а затем в динамике (через 12, 18 и 24 ч).
В этих условиях значительно чаше регистрируется увеличение трансаминаз, имеющее диагностическое значение. Если сделан только один анализ (при поступлении больного в стационар), то его результатам не следует доверять. Надо помнить о том, что выход трансаминаз происходит дискретно, в связи с расширением зоны некроза (который имеет определенный темп нарастания). Так, ACT (ее много в скелетных мышцах) повышается через 6—12 ч, пик наблюдают на 2-е сутки, а нормализацию — в конце 1-й (а то даже и в начале 2-й) недели.
Лактатдегидрогеназа (ЛДГ) также содержится во многих органах (и в немалом количестве). Суммарная ЛДГ (имеется 5 изоэнзимов) — поздний маркер ИМ, она реагирует позже, чем остальные ферменты. Ее определение обычно производят у больных, поздно поступающих в стационар (через 48—72 ч от начала ИМ). Изофермент ЛДГ] (его много в сердце) информативнее, ибо его уровень повышается раньше, чем суммарная ЛДГ, а кроме того, может увеличиваться на фоне ее нормальных значений. Обычно ЛДГ определяют, когда видят, что повышена КФК.
Уже с 4—6-го ч (а иногда и со 2-го ч) инфаркт миокарда на фоне нормальных значений СОЭ начинает появляться лейкоцитоз — обычно до 12—15-10 /л, нередко со сдвигом формулы влево. Уровень лейкоцитоза лучше, чем лихорадка, отражает размеры некротического очага. Высокий лейкоцитоз (более 20-10 /л) — неблагоприятный прогностический признак. Лейкоцитоз обычно сохраняется 3—4 дня и к концу 1-й недели снижается, если нет осложнений. В тяжелых случаях он длится более 10 дней (особенно, если появляются осложнения).
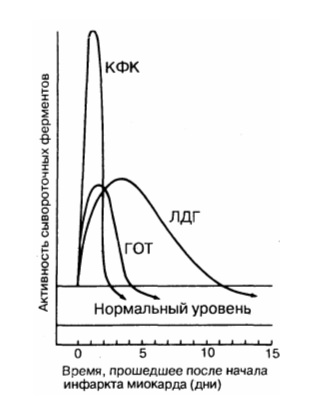
КФК — креатинфосфокиназа; ЛДГ — лактатдегидрогеназа; ГОТ — глутаматрксалоацетаттрансаминаза.
Со 2-го дня инфаркт миокарда постепенно, медленно начинает повышаться СОЭ (максимум до 30 мм/ч). Пик ее значений отмечается между 12-м днями (к этому времени число лейкоцитов нормализуется — феномен «ножниц»), потом СОЭ нормализуется. Если она превысила 30 мм/ч — «жди осложнений ИМ».
Со 2-го дня инфаркт миокарда (иногда уже через 4—8 ч) начинает увеличиваться и температура тела (как неспецифический ответ на некроз миокарда) до невысоких цифр (37,3—38,0 °С), держится в течение 5—6 дней и нормализуется обычно к 6—10-му дню. Интенсивность лихорадки и ее длительность индивидуальны, зависят от обширности ИМ и реактивности организма в целом. Температурной кривой, характерной для ИМ, нет. Обычно (но не всегда) чем больше зона ИМ, тем выше лихорадка (кроме КШ, когда лихорадки нет).
Появление лихорадки после ангинозного приступа является важным диагностическим симптомом инфаркта миокарда (отличает его от Ст) и должно настораживать врача. Длительное сохранение ее указывает на формирование осложнений ИМ (тромбоэндокардит, затяжное течение).
Регистрация изменений числа лейкоцитов, СОЭ и температуры тела имеет значение в диагностике мелкоочагового инфаркта миокарда, если нельзя опредечить ферменты.
Сохраняет свое некоторое диагностическое значение и рост показателей острой фазы воспаления — СРП, фибриногена, сиаловых кислот, альфа2- и у-глобулинов.
Для достоверного диагноза инфаркта миокарда необходимо иметь 2 или 3 надежных критерия. Возможны разные комбинации трех ведущих критериев ИМ, поэтому в каждом конкретном варианте необходим свой минимум обследований. ЭКГ-признаки ИМ могут и отсутствовать, поэтому ИМ нужно ставить всегда с учетом динамики клинических симптомов.
По материалам meduniver.com
Трансаминаза – это общее название ферментов, находящихся внутри клеток разных органов. При разрушении или повреждении тканей, при травмах или патологиях, ферменты выходят из клеток, поэтому их уровень в крови повышается.
Содержание трансминазы в крови имеет значение в диагностике, поскольку является признаком определенных заболеваний. Особое внимание в диагностической практике уделяется двум видам ферментов – АСТ и АЛТ. Их содержание в крови служит маркером поражений печени, сердца, поджелудочной железы (самые частые случаи – гепатит, инфаркт миокарда, панкреатит). Их абсолютные значения и соотношение уровней АСТ И АЛТ позволяют определить пораженный орган, проследить динамику патологического процесса и установить степень поражения.
Содержание трансаминазы определяют во время биохимического исследования. Кровь на анализ берут из вены. Накануне процедуры нельзя есть жирную пищу, принимать алкоголь, заниматься тяжелым физическим трудом, а также следует за одну-две недели до сдачи прекратить прием некоторых препаратов по согласованию с врачом.
Полное название фермента – аланинаминотрансфераза. Из названия понятно, что этот белок занимается переносом аминокислоты аланина. В основном содержится в печени, а также в клетках сердца, поджелудочной железы, почек, мышц.
Для женщин и мужчин допустимые значения разные:
- для женщин норма составляет не выше 32 единиц/литр;
- для мужчин – менее 40 единиц/литр.
Для детей разного возраста нормы отличаются:
- в первые пять дней жизни – до 49 единиц/литр;
- до полугода – 56;
- от полугода до года – 54;
- от года до трех – 33;
- от трех до шести лет – 29;
- от шести до 12 – не выше 39.
Высокий уровень АЛТ характерен для таких патологий:
- цирроз печени;
- острый гепатит (вирусный, алкогольный);
- острый панкреатит;
- злокачественная опухоль печени или метастазы;
- механическая желтуха;
- распад опухоли;
- обширный инфаркт;
- заболевания сердца, при которых происходит разрушение клеток сердечной мышцы (сердечная недостаточность, миокардит);
- ожоги;
- обширные травматические повреждения мышц.
Незначительное повышение наблюдается в следующих случаях:
- после операции на сердце;
- при неосложненном инфаркте;
- хроническом гепатите;
- жировом гепатозе;
- мононуклеозе.
Кроме патологических причин повышения уровня АЛТ, есть физиологические. К ним относятся:
- большие физические нагрузки;
- прием некоторых лекарственных препаратов (антибиотиков, валерианы, эхинацеи, нестероидных противовоспалительных средств, контрацептивов);
- прием некоторых БАДов, которые негативно влияют на печеночные клетки;
- незначительное повышение может наблюдаться у беременных в первом триместре (такое состояние считается нормальным);
- неправильное питание (присутствие в рационе фастфуда, газировок, блюд из полуфабрикатов).
Особое значение имеет показатель в диагностике болезней печени. Высокий уровень АЛТ – это специфический признак печеночной патологии. Уже за 1-4 недели до появления симптоматики в крови обнаруживается повышенное содержание этого фермента. В случае острого заболевания печени он превышает норму более чем в пять раз. Если высокий уровень сохраняется в течение длительного времени или на поздних стадиях болезни происходит его рост, то это свидетельствует о массивном разрушении тканей печени.
- при диагностике патологий печени, желчевыводящих путей, поджелудочной железы;
- для контроля лечения вирусного гепатита;
- при дифференциальной диагностике печеночной и гемолитической желтухи;
- при сердечной недостаточности и других сердечных заболеваниях;
- при патологиях скелетной мускулатуры;
- при обследовании крови донора.
Анализ назначают людям со следующей симптоматикой:
- постоянная слабость;
- быстро наступающая усталость;
- плохой аппетит;
- темная моча и светлый кал;
- желтизна кожи и белков глаз;
- вздутие живота;
- тошнота, рвота;
- боль в животе.
Анализ на АЛТ может быть назначен людям, находящимся в группе риска:
- имевшим контакт с больным гепатитом;
- страдающим сахарным диабетом;
- имеющим лишний вес;
- страдающим алкогольной зависимостью;
- принимающим лекарства с токсическим действием;
- людям с наследственной склонностью к болезням печени.
АСТ, или аспартатаминотрансфераза, участвует в переносе аминокислоты аспартата. Содержится преимущественно в сердце, печени, почках, мышцах.
Содержание АСТ в крови должно составлять:
- у женщин – от 20 до 40 единиц/литр;
- у мужчин – от 15 до 31 единиц/литр;
- у новорожденных (5 суток) – до 140 единиц/литр;
- у детей до девяти лет – не более 55.
Повышенная активность АСТ в крови наблюдается в следующих случаях:
- при гепатитах разного происхождения;
- инфаркте миокарда;
- миокардите;
- воспалении сердечной мышцы при острой ревматической лихорадке;
- раке печени и вторичных опухолях в печени;
- циррозе и некрозе печени;
- алкоголизме;
- аутоиммунных заболеваниях мышц;
- панкреатите (остром и хроническом);
- желчнокаменной болезни и других патологиях, при которых нарушен отток желчи;
- холестазе;
- мононуклеозе;
- гепатозе;
- ожогах;
- тепловом ударе;
- отравлении грибами;
- травмах.
При инфаркте миокарда АСТ в крови повышается в 5 раз и держится на высоком уровне в течение пяти суток, при этом АЛТ возрастает незначительно. Если снижения не происходит спустя пять дней, можно говорить о плохом прогнозе, а если уровень растет, вероятно, зона некроза тканей миокарда расширилась.
Повышается содержание АСТ и при некрозе тканей печени. Чем выше его значение, тем тяжелее поражение.
Чтобы по анализу крови узнать, в каком органе – миокарде или печени – происходит разрушение тканей, нужно определить соотношение АСТ/АЛТ, норма которого – 1,3. Если значение превышает 1,3, это инфаркт, если ниже нормы – печеночная патология.
Определение уровня трансаминазы в крови имеет большое значение при диагностике некоторых заболеваний. Содержание АЛТ особенно важно для выявления печеночных патологий разного происхождения. Изменения такого показателя, как АСТ, в сторону увеличения – важный диагностический признак повреждения клеток миокарда при инфаркте.
По материалам serdec.ru