10) Лекарственная устойчивость мбт, механизм развития. Виды лекарственной устойчивости мбт, значение в клинике.
Важным признаком изменчивости МБТ . является устойчивость к одному или нескольким противотуберкулезным препаратам. Виды лекарственной устойчивости:
— первичная — устойчивость МБТ к противотуберкулезным препаратам(ПТП) у больных туберкулезом, которые ранее не получали специфической терапии.
— начальная — устойчивость МБТ к ПТП у больных туб., которые ранее могли их получать. Включает
первичную и не выявленную приобретенную.
— приобретенная (вторичная) -устойчивость у больных , которым ранее проводилась специфическая терапия.
— монорезистснтность — устойчивость к одному ПТП.
— полирезистснтносгь — устойчивость к двум и более ПТП, но не к сочетанию изониазида и рифампицина.
— множественная — -//- + сочетание изониазида и рифампицина
— перекрестная (полная и неполная)
Основные механизмы развития лекарственной устойчивости
Поэтому для химиотерапии применяют не менее 4-х препаратов; если препарат = 40 мкг/мл и МБТ устойчива—что нужно исключать.
Методы определения лекарственной устойчивости
1 .Классические: -м-д пропорций
-м-д коэффициента устойчивости -м-д абсолютных концентраций
-радиометрический м-д системы ВАС ГЕС
На внедрение микобактерий в организм, в нем возникают ответные (защитные) реакции, что обусловлено воздействием специфических и неспецифических факторов защиты:
1 .Неспецифическая защита: в первую очередь лишена специфичности и непосредственно на тбк не действует. Представлена:
• клеточный компонент: лейкоциты, макрофаги — обеспечивают фагоцитоз, препятствуют распространению тбк;
• гуморальный компонент: интерферон, лизоцим, комплемент. AT передаются трансплацентарно. Неспецифическая защита не способна распознать вторично поступающих микобактерий, не способна
уничтожить и запомнить AT тбк, но на основе неспецифической формируется специфическая. 2.Снецифическая — формируется на основе неспецифической, представлена иммунными реакциями на основе иммунокомпетентных органов (центральных и периферических). Основную клинику обеспечивают Т и В лимфоциты. После контакта лимфоцитов с тбк они становятся активированными и формируют иммунный о твет.
При первом проникновении — микобактерий фагоцитируют нейтрофилы или макрофаги, в них микобактерии не разрушаются (возможно выделение клеток). Информация о контакте передается Т и В лимфоцитам через РНК либо через АГ, далее они трансформируются либо в Т2 клетки, либо в субпопуляции В-клеток.
В-клетки, плазмоциты, иммуноглобулин М на Т-лимфоцитарную систему ; пассивные рецепторы на Т- клетках (активируют Т-лимфоциты, а макрооргангизмы сенсибилизируют). Т-активированные лимфоциты лимфокины(бактериостатическое действие, реактивный фактор, учакстник некроза, снижает пролиферацию других клеток). Каждый лимфокин имеет свой антагонист. Т-активированные лимфоциты взаимодействуют с макрофагами (-*- ингибиция, перемещение макрофагов, + индукция превращения в эпителиальную гигантскую клетку, t макрофаги выделяют монокины). Феномен гиперчувствительности замедленного типа зависит от Т-лимфоцитов.
Местные реакции: образование классической гбк гранулемы (барьерная функция), перифокальное воспаление вокруг гранулемы.
Общие реакции: параспецифические (гистиоцитарная и лимфоцитарная инфильтрации вокруг сосудов), аллергические (способность макроорганизма отвечать воспалительной реакцией на повторное проникновение микобактерий гбк..
Развивается медленно, начало 8-24 часа от момента контакта и заканчивается в течении 4-6 часов. Стадии:
источник
7) Классификация микобактерий туберкулеза, типы микобактерий, их роль в развитии заболеваний у человека.
1 .Mie. tuberculosis — 92% заболевания тбк у человека
2.Mic. bovis — увеличение патогенности для крупного рогатого скота, кроликов, человека.
3. Mic. avis -становится сапрофитом.
4. Mic. Mulcus, OVS (мышиный)-вариант бычьего, вызывает местное поражение у человека. Промежуточный вид: Mic. africanum — 1969г. выделена у человека из Африки.
Атипичные микобактерии вызывают микобакгериоз, сходный с тбк., но не лечится ГГГП:
1) 1Патогенность атипичных микобактерии выше.
2) Потенциальная патогенность.
3) Сапрофиты: сходны с микобактериями тбк..
Группы атипичных микобактерий:
Фотохромогенные: на свету — желтый пигмент, растут медленно, высокая устойчивость к ПТ11, содержатся в бассейнах, рыбе, почве. Примеры: Mic. cansasi, Mic. belli. Скотохромогенные на свету образует оранжевый и красный пигмент, а в темноте — желтый, i Непигментные: бесцветные, близко стоят к птичьему виду возбудителя, i . Быстрорастущие.
9) Патогенность и вирулентность микобактерий туберкулеза Методы определении вирулентности мбт в клинике
Патогенность — способность жить и размножаться в организме человека, способность вызывать специфические реакции и болезнь.
Вирулентность — мера патогенности, ее выраженность, которая характеризуется дозой попавших в организм микобактерий, интенсивностью их размножения, сроком длительности жизни человека, заразившегося тбк..
Выраженность характера вирулентности определяется по типу колоний, по С(ЖО-фактору(определяется у высоко вирулентных штаммов, а именно определяется за счет слипания микобактерий и образования кос Прайса в жидких питательных средах), по типу химической р-ции, по каталазной активности(чем выше активность, тем выше вирулентность), биологической пробе(на морских свинках).
Наиболее чувствительными животными для определения вирулентности микобактерий туберкулеза являются морские свинки, обладающие слабой естественной защитой против туберкулезной инфекции. Для изучения вирулентности микобакгерий суспензию штамма’МБТ вводят подкожно двум морским свинкам в паховую область и ведут наблюдение за их весом, поведением, местными изменениями. Погибших морских свинок вскрывают. Для оценки степени вирулентности МБТ используют несколько критериев. Один из них — продолжительность жизни лабораторных животных использованных в эксперименте. К высоковирулентным относят культуры, вызывающие гибель морских свинок от генерализованного туберкулеза в период до 45 дней после заражения, к средневирулентным — при гибели через 1,5-3 месяца, к слабовирулентным — при г ибели через 3-5 месяцев и более. Вирулентность культур МБТ можно оценивать также по степени пораженное™ внутренних органов, выраженной в баллах (по М.В. Триус). По этой схеме специфические изменения в органах и лимфатических узлах зараженных свинок оцениваются в зависимости от степени их выраженности плюсами, которые затем переводятся в цифровые показатели. Одним плюсом обозначается наличие единичных очагов в органе (селезенке, печени, легком), тремя плюсами — тотальное поражение, двумя — промежуточная степень поражения. При исследовании лимфатических узлов каждый плюс оцениватся в 1 балл, селезенки — в 2. печени — 3, легких — 4 балла. Таким образом, при максимальных специфических изменениях цифровое обозначение поражения выражается цифрой 30. Е.Ф. Чернушенко разработана схема макроскопической оценки поражения внутренних органов морских свинок, зараженных туберкулезом, согласно которой максимальное поражение организма оценивается в 100 баллов. Эта схема позволяет проводить статистическую обработку результатов. Вирулентность культур микобактерий можно оценивать также по индексу пораженности, предложенному Mitchison. Данный индекс рассчитывают как квадратный корень из отношения пораженности внутренних органов, выраженной в баллах, к числу прожитых животным дней. Такой способ оценки учитывает скорость развития специфических поражений во внутренних органах лабораторных животных. При величине индекса пораженности 1 и более штамм микобактерий относят к высоковирулентным.
источник
10. Лекарственная устойчивость мбт, механизм развития. Виды лекарственной устойчивости мбт, значение в клинике.
Важным признаком изменчивости МБТ . является устойчивость к одному или нескольким противотуберкулезным препаратам. Виды лекарственной устойчивости:
— первичная — устойчивость МБТ к противотуберкулезным препаратам(ПТП) у больных туберкулезом, которые ранее не получали специфической терапии.
— начальная — устойчивость МБТ к ПТП у больных туб., которые ранее могли их получать. Включает
первичную и не выявленную приобретенную.
— приобретенная (вторичная) -устойчивость у больных , которым ранее проводилась специфическая терапия.
— монорезистснтность — устойчивость к одному ПТП.
— полирезистснтносгь — устойчивость к двум и более ПТП, но не к сочетанию изониазида и рифампицина.
— множественная — -//- + сочетание изониазида и рифампицина
— перекрестная (полная и неполная)
Основные механизмы развития лекарственной устойчивости
Поэтому для химиотерапии применяют не менее 4-х препаратов; если препарат = 40 мкг/мл и МБТ устойчива—что нужно исключать.
Методы определения лекарственной устойчивости
1 .Классические: -м-д пропорций
-м-д коэффициента устойчивости -м-д абсолютных концентраций
-радиометрический м-д системы ВАС ГЕС
На внедрение микобактерий в организм, в нем возникают ответные (защитные) реакции, что обусловлено воздействием специфических и неспецифических факторов защиты:
1 .Неспецифическая защита: в первую очередь лишена специфичности и непосредственно на тбк не действует. Представлена:
• клеточный компонент: лейкоциты, макрофаги — обеспечивают фагоцитоз, препятствуют распространению тбк;
• гуморальный компонент: интерферон, лизоцим, комплемент. AT передаются трансплацентарно. Неспецифическая защита не способна распознать вторично поступающих микобактерий, не способна уничтожить и запомнить AT тбк, но на основе неспецифической формируется специфическая.
2.Специфическая — формируется на основе неспецифической, представлена иммунными реакциями на основе иммунокомпетентных органов (центральных и периферических). Основную клинику обеспечивают Т и В лимфоциты. После контакта лимфоцитов с тбк они становятся активированными и формируют иммунный ответ.
При первом проникновении — микобактерий фагоцитируют нейтрофилы или макрофаги, в них микобактерии не разрушаются (возможно выделение клеток). Информация о контакте передается Т и В лимфоцитам через РНК либо через АГ, далее они трансформируются либо в Т2 клетки, либо в субпопуляции В-клеток.
В-клетки, плазмоциты, иммуноглобулин М на Т-лимфоцитарную систему ; пассивные рецепторы на Т- клетках (активируют Т-лимфоциты, а макрооргангизмы сенсибилизируют). Т-активированные лимфоциты лимфокины(бактериостатическое действие, реактивный фактор, учакстник некроза, снижает пролиферацию других клеток). Каждый лимфокин имеет свой антагонист. Т-активированные лимфоциты взаимодействуют с макрофагами (-*- ингибиция, перемещение макрофагов, + индукция превращения в эпителиальную гигантскую клетку, t макрофаги выделяют монокины). Феномен гиперчувствительности замедленного типа зависит от Т-лимфоцитов.
Местные реакции: образование классической тбк гранулемы (барьерная функция), перифокальное воспаление вокруг гранулемы.
Общие реакции: параспецифические (гистиоцитарная и лимфоцитарная инфильтрации вокруг сосудов), аллергические (способность макроорганизма отвечать воспалительной реакцией на повторное проникновение микобактерий гбк..
Развивается медленно, начало 8-24 часа от момента контакта и заканчивается в течении 4-6 часов. Стадии:
• натохимическая (выделение лимфокинов)
• патофизиологическая (воспалительная) Возникают остаточные иммуноглобулины.
AT образуются к различным фракциям микобактерий тбк (полисахариды, фосфатиды, гликопептиды). Действие AT различно:
AT к факторам вирулентности очень токсичны
AT к протеинам могут блокировать эффекторные механизмы иммунного ответа AT к полисахаридам способны увеличивать фагоцитоз.
• увеличение титров может неблагоприятно влиять на течение тбк (повреждаются ткани) уменьшение титра — ослабление организма.
AT не идеальная защита от тбк, особенно когда микобактерии располагаются внеклегочно; гуморальный иммунитет имеет вторичное значение. Иммунитет: контактный, инфекционный, приобретенный, клеточно-гуморальный. При вторичном попадании тбк гранулема образуется в 1.5-2 раза быстрее, увеличение сопративляемости ткани, ферменты быстро разрушают микобактерию. Иммунитет может быть относительный; нестойкий — заболевание возможно.
источник
Лекарственная устойчивость — закономерное и одно из самых значимых проявлений изменчивости МБТ, отражающей основной биологический закон, выражение приспособления биологических видов к окружающей среде.
По последним научным данным, основные механизмы развития лекарственной устойчивости МБТ к противотуберкулезным препаратам — мутации в гене, ответственном за обменные процессы, и синтез белка-фермента, инактивирующего конкретный препарат.
Изучение биологических особенностей, ферментативной активности, химического состава лекарственно-устойчивых МБТ в сравнении с лекарственно-чувствительными, генетически однородными МБТ позволило выделить несколько основных механизмов, обусловливающих резистентность бактериальной клетки к данному антибактериальному агенту:
• появление нового пути обменных процессов, обходящего те обменные процессы, на которые воздействует данный препарат;
• увеличение синтеза фермента, который инактивирует данный препарат;
• синтез измененного фермента, который слабее инактивируется данным препаратом;
• уменьшение проницаемости бактериальной клетки в отношении данного препарата.
Все эти процессы могут происходить внутри бактериальной клетки и на уровне клеточной мембраны МБТ.
К настоящему времени установлены характерные особенности МБТ, устойчивых к различным противотуберкулезным препаратам, и изучены практически все гены, контролирующие лекарственную устойчивость к этим препаратам.
В большой и активно размножающейся микобактериальной популяции всегда имеется небольшое количество лекарственно-устойчивых спонтанных мутантов.
С учетом того что в каверне величина микобактериальной популяции составляет 10 -8… -11 там имеются мутанты ко всем противотуберкулезным препаратам. Поскольку большинство мутаций специфичны для отдельных препаратов, спонтанные мутанты, как правило, устойчивы только к одному препарату. Это явление называют эндогенной (спонтанной) лекарственной устойчивостью МБТ.
При правильном проведении химиотерапии эти мутанты практического значения не имеют, однако в результате неправильного лечения, когда больным назначают неадекватные режимы и сочетания противотуберкулезных препаратов и не дают оптимальные дозы при расчете в мг/кг массы тела больного, изменяется соотношение между количеством лекарственно-устойчивых и чувствительных МБТ. Происходит естественный отбор лекарственно-устойчивых мутантов к противотуберкулезным препаратам при неадекватной химиотерапии, что при длительном воздействии может вести к изменению генома микобактериальной клетки без обратимости чувствительности. В этих условиях происходит размножение главным образом лекарственно-устойчивых МБТ, эта часть бактериальной популяции увеличивается. Это явление
определяется как экзогенная (индуцированная) лекарственная устойчивость.
Наряду с этим выделяют первичную лекарственную устойчивость —
устойчивость МБТ, определяемую у больных туберкулезом, не принимавших противотуберкулезные препараты. В данном случае больной заразился МБТ с устойчивостью к противотуберкулезным препаратам.
Первичная лекарственная устойчивость МБТ у больного туберкулезом характеризуется состоянием микобактериальной популяции, циркулирующей в данном регионе или стране, и ее показатели важны для оценки степени напряженности эпидемической ситуации и выработки региональных режимов химиотерапии.
Вторичная (приобретенная) лекарственная устойчивость определяется как устойчивость МБТ, развивающаяся в процессе химиотерапии у конкретного больного туберкулезом. Приобретенную лекарственную устойчивость следует рассматривать у тех больных, которые имели в начале лечения чувствительные МБТ, с развитием устойчивости через 3—6 мес.
Вторичная лекарственная устойчивость МБТ — объективный клинический критерий неэффективно проводимой химиотерапии. В клинической практике необходимо исследовать лекарственную чувствительность МБТ и по результатам этих данных подбирать соответствующий индивидуальный режим химиотерапии, а его эффективность сопоставлять с динамикой туберкулезного процесса.
По эпидемиологической классификации ВОЗ (2008) МБТ могут быть:
• монорезистентными (МР) — к одному противотуберкулезному препарату;
• полирезистентными (ПР) — к двум и более противотуберкулезным препаратам, но не к сочетанию изониазида и рифампицина;
• множественно лекарственно-резистентными (МЛУ) — как минимум к сочетанию изониазида и рифампицина;
• широко лекарственно-резистентными (ШЛУ) — как минимум к сочетанию изониазида, рифампицина, фторхинолонов и инъекционных препаратов (канамицина, амикацина и капреомицина).
Данная классификация дает представление о частоте распространенности региональной первичной и вторичной лекарственной устойчивости МБТ к трем самым эффективным противотуберкулезным препаратам — изониазиду, рифампицину и фторхинолонам, особенно при их сочетании. Это обусловлено тем, что частота распространенности МЛУ и ШЛУ в каждой стране различна.
Туберкулез легких — инфекционное заболевание, при котором развитие эпидемиологического процесса и химиотерапия больных зависят от частоты и характера лекарственной устойчивости МБТ, циркулирующих в данном регионе, что обусловливает региональный подбор наиболее эффективной комбинации противотуберкулезных препаратов.
Региональный подбор комбинации противотуберкулезных препаратов для химиотерапии больных туберкулезом должен соответствовать уровню распространенности МЛУ МБТ в конкретном регионе и стране.
В клинических условиях для эффективного проведения химиотерапии у конкретного больного необходимо знать индивидуальный спектр лекарственной чувствительности МБТ.
По клинической классификации В.Ю. Мишина (2002) больных, выделяющих МБТ, разделяют на три группы:
•больные с МБТ, чувствительными ко всем противотуберкулезным препаратам;
•больные с ПР и МЛУ МБТ к основным противотуберкулезным препаратам;
•больные с ПР и МЛУ МБТ к сочетанию основных и резервных противотуберкулезных препаратов.
Эта классификация определяет индивидуальную устойчивость МБТ. Такое деление лекарственной устойчивости имеет клиническое значение в плане адекватности режимов химиотерапии, что позволяет персонально подбирать дозу и комбинации основных и резервных противотуберкулезных препаратов у конкретного больного.
источник
Возникновение и течение туберкулеза зависят от особенностей его возбудителя, реактивности организма и санитарно-бытовых условий. Современное название возбудителя — микобактерия туберкулеза. Старое название — бактерия Коха (БК). 24 марта 1882 Р. Кох продемонстрировал чистую культуру возбудителя под микроскопом, также он доказал его инфекционную природу, заразив животных. Поэтому микроб назван его именем. Следует отметить, что 18 марта 1882 Баумгартен, также немецкий ученый, показал палочку туберкулеза, выделенную из органов кролика, пораженного туберкулезом, но только под микроскопом.
Возбудитель туберкулеза относится к роду микобактерий, семьи актиномицетов и класса шизомицетив. К роду микобактерий относятся также возбудитель лепры и группа сапрофитов, которые встречаются в выделении из ушей, в мокроте при бронхоэктазах, а также кислотоустойчивые микроорганизмы, вегетирующие на слизистых оболочках человека, в сливочном масле, молоке, на растениях, в воде, почве и т. д.
По патогенности для человека и для отдельных видов микобактерии делятся на 2 группы. Первая группа — собственно патогенные микобактерии туберкулеза, среди которых выделяют три вида. Вторая группа — атипичные микобактерии, среди которых есть сапрофиты — не патогенные для людей и животных и условно патогенные микобактерии — при некоторых условиях могут вызвать микобактериоз, который напоминает туберкулез.
По одной из классификаций они разделены на четыре группы (в зависимости от скорости роста и пигментообразования).
- I группа — фотохромогенные микобактерии — образуют лимонно-желтый пигмент во время экспозиции культуры на свете, колонии вырастают в течение 2-3 недель. Источником инфекции могут быть крупный рогатый скот, молоко и другие молочные продукты.
- II группа — скотохромогенные микобактерии, которые образуют оранжево-желтый пигмент в темноте. Распространены в воде и в почве.
- III группа — нефотохромогенные микобактерии. Культуры слабопигментированные или непигментированные, видимый рост оказывается уже через 5-10 суток. Различные по вирулентности и оптимальной температурой роста. Случаются в почве, в воде, в различных животных (свиней, овец).
- IV группа — микобактерии, которые быстро растут на питательных средах. Рост дают через 2-5 дней.
Атипичные микобактерии определяются в 0,3-3% культур, чаще вследствие загрязнения среды. Этиологическая роль их считается доказанной, если из патологического материала они высеваются повторно и их рост характеризуется большим количеством колоний, а других возбудителей заболевания нет.
Заболевание, вызванное атипичными штаммами микобактерий туберкулеза, называют микобактериозом. Из штаммов атипичных микобактерий получен продукт их жизнедеятельности — сенситин. При внутрикожном введении сенситина у больных микобактериозом возникает положительная реакция. По клиническому течению микобактериоз напоминает туберкулез, иногда сопровождается кровохарканьем, быстро прогрессирует.
Различают три типа микобактериоза, которые зависят от вида микобактерий и иммунного статуса организма:
1. Генерализованная инфекция с развитием видимых невооруженным глазом патологических изменений внешне напоминают туберкулезные, но гистологически несколько отличаются от них. В легких обнаруживают диффузные интерстициальные изменения без гранулем и полостей распада. Основными признаками являются повышение температуры тела, двусторонняя диссеминация в средних и нижних отделах легких, анемия, нейтропения, хроническая диарея и боль в животе. Диагноз подтверждается нахождением возбудителя в мокроте, кале или биопсией. Эффективность лечения низкая, смертность высокая и достигает 20%. Эффективными для лечения при микобактериоза является циклосерин, этамбутол, канамицин, рифампицин и частично стрептомицин.
2. Локализованная инфекция — характеризуется наличием макро- и микроскопических поражений, выявляемых в определенных участках тела.
3. Инфекция, которая протекает без развития видимых поражений; возбудитель находится в лимфатических узлах.
Туберкулез у людей преимущественно (95-97%) возникает вследствие заражения человеческим, реже (3-5%) бычьим и казуистически — птичьим видом микобактерий туберкулеза. М. africanum вызывает туберкулез у людей в странах Тропической Африки.
Микобактерии туберкулеза имеют форму тонких, длинных или коротких, прямых или искривленных палочек, длиной 1,0-4,0 мкм и диаметром 0,3-0,6 мкм; неподвижные, спор и капсул не образуют, грамположительные, имеют большой полиморфизм.
Микобактерии туберкулеза человеческого вида более тонкие и длинные, чем бычьего. Микобактерии бычьего вида менее патогенны для людей, и заболевание, вызванное ими, встречается значительно реже. Для определения МБТ человеческого вида применяют ниациновий тест. Он базируется т том, что МБТ этого вида выделяют больше ниацина (никотиновой кислоты).
Молодые бактерии гомогенные, в процессе их старения образуется зернистость (зерна Муха), которая более подробно изучается методом электронной микроскопии. Зернистая форма микобактерий туберкулеза образуется также под влиянием антимикобактериальных препаратов. После введения зерен животным у них возникает кахексия, увеличение лимфатических узлов или заболевания туберкулезом с развитием типичных штаммов микобактерий туберкулеза. Описанные оскольчатые формы микобактерий туберкулеза. Возбудитель туберкулеза может существовать также в виде фильтрующихся форм.
Под влиянием противотуберкулезных препаратов морфологические и физико-химические свойства микобактерий туберкулеза изменяются. Микобактерии становятся короткими, приближаясь к кокобацилам, их кислотостойкость уменьшается, поэтому при окраске по Цил-Нильсену они обесцвечиваются и не определяются.
Микобактерии туберкулеза размножаются поперечным делением, ветвлением или отпочкование отдельных зерен. Микобактерии туберкулеза растут на питательных средах при наличии кислорода. Но они являются факультативными аэробами, т.е. растут и когда доступа воздух не имеет — кислород они получают из углеводов. Поэтому для выращивания микобактерий требуется питательная среда, богатая углеводами.
Эффективны плотные среды, в состав которых входят яйца, молоко, картофель, глицерин. Чаще применяют среды Левенштейна-Иенсена, Гельберга, Финна-2, Миддлбрука, Огава.
Микобактерии туберкулеза растут медленно. Первые колонии появляются на 12-30-й день, а иногда и через 2 месяца. Для обеспечения роста микобактерий туберкулеза к питательным средам добавляют 3-6% глицерина. Микобактерии лучше растут в слабо-щелочной среде, хотя могут расти и в нейтральной.
Добавление желчи в питательную среду замедляет их рост. Это обстоятельство использовали Кальметт и Герен при разработке вакцины. На жидких питательных средах с добавлением глицерина микобактерии туберкулеза растут в виде пленки. Колонии микобактерий могут быть шероховатыми (К.-варианты) и реже — гладкими, сливающимися между собой (8-варианты). К.-варианты микобактерий вирулентные для людей и животных, а 8-варианты чаще невирулентные.
Микобактерия состоит из клеточной оболочки и цитоплазмы. Клеточная оболочка трехслойная и состоит из наружного, среднего и внутреннего слоев. В вирулентных микобактерий она имеет толщину 230-250 нм.
Внешний слой, окружающий клетку, называют микрокапсулой. Она образована полисахаридами и содержит фибриллы. Микрокапсула может окружать целый популяцию микобактерий, а также помещаться на местах прилегания микобактерий друг к другу. Отсутствие или наличие роста, его интенсивность и состав микрокапсулы зависят от того, какое количество корд-фактора экстрагируется из цитоплазмы в клеточную стенку. Чем больше корд-фактора экстрагируется, тем лучше выражена микрокапсула у микобактерий туберкулеза.
Клеточная оболочка участвует в регуляции метаболических процессов. В ней содержатся видоспецифические антигены, благодаря чему клеточная стенка является локусом, где происходят аллергические реакции повышенной чувствительности замедленного типа и образование антител, поскольку она, как собственно поверхностная структура бактериальной клетки, первой контактирует с тканями макроорганизма.
Под клеточной оболочкой расположена трехслойная цитоплазматическая мембрана, тесно прилегает к цитоплазме. Она состоит из липопротеидных комплексов. В ней происходят процессы, обусловливающие специфичность реакции микобактерий на факторы окружающей среды.
Цитоплазматическая мембрана микобактерий туберкулеза путем своей центростремительной инвагинации формирует в цитоплазме внутрицитоплазматическая мембранную систему — мезос. Мезосомы — полуфункциональные структуры. В них содержится много ферментных систем. Они участвуют в синтезе и формировании клеточной стенки и выполняют роль посредника между ядром и цитоплазмой бактериальной клетки.
Цитоплазма микобактерий состоит из гранул и включений. У молодых микобактерии туберкулеза цитоплазма более гомогенная и компактная, чем у старых, у которых в цитоплазме больше вакуоль и полостей. Основную массу гранулярных включений составляют рибосомы, располагающиеся в цитоплазме в свободном состоянии или образующие полисомы — скопление рибосом. Рибосомы состоят из РНК и белка и синтезируют специфический белок.
Иммуногенность микобактерий туберкулеза обусловлена в основном антигенными комплексами, содержащихся в оболочках микобактериальных клеток. Рибосомы, рибосомный белок и цитоплазма микобактерий имеют антигенную активностью в реакциях замедленного типа.
Химический состав микобактерий туберкулеза изучен достаточно хорошо. Они содержат 80% воды и 2-3% золы. Сухой остаток наполовину состоит из белков, преимущественно туберкулопротеинов, липидов — от 8 до 40%, столько же полисахаридов. Предполагают, что туберкулопротеины являются полноценными антигенами и могут вызывать у животных состояние анафилаксии. Липидная фракция приводит резистентность возбудителя туберкулеза, а полисахаридная участвует в иммуногенезе.
Туберкулопротеины и липидные фракции обусловливают токсичность микобактерий туберкулеза, которая присуща не только живым, но и убитым микроорганизмам. Выявлено три фракции липидов: фосфатидная, жировая и восковая. Большое содержание липидов отличает микобактерии туберкулеза от других видов микроорганизмов и приводит следующие свойства:
1. Устойчивость к кислотам, щелочам и спиртам (преимущественно обусловлено наличием миколевой кислоты).
2. Устойчивость против обычных дезинфицирующих веществ.
3. Патогенность туберкулезных микобактерий.
Экзотоксины не определены, но сами клетки микобактерий токсичные — приводят к частичному или полному распаду лейкоцитов. В неорганическом остатке микобактерий туберкулеза определяют соли железа, магния, марганца, калия, натрия, кобальта. Антигенная структура микобактерий сложная и еще не в совершенстве изучена.
Микобактерии имеют специфические видовые и межвидовые и даже межродовые антигенные связи. В отдельных штаммах выявлены различные антигены. Однако все без исключения микобактерии содержат вещества, устойчивые к нагреванию и воздействию протеолитических ферментов — полисахариды, которые являются общим антигеном.
Кроме того, различные виды микобактерий имеют свои специфические антигены. А. П. Лысенко (1987) доказал, что все штаммы M. bovis имеют идентичный антигенный спектр с 8 антигенов, из которых 5-6 были общеродовыми и реагировали с антисыворотками к микобактерий других видов: 6 — с M. tuberculosis, 3-5 — M. kansasii и т.д.
Патогенность — это видовое свойство микобактерий туберкулеза, оказывается возможностью вызвать заболевание. Главным фактором патогенности являются токсические гликолипиды — корд-фактор. Это вещество, которое склеивает вирулентные микобактерии, благодаря чему они растут на питательных средах, в виде жгутов. Корд-фактор обусловливает токсическое действие на ткани и защищает туберкулезные палочки от фагоцитоза, блокируя окислительное фосфорилирование в митохондриях макрофагов. Поэтому, поглощены фагоцитами, они размножаются в них и вызывают их гибель. Кислотостойкие сапрофиты не образуют корд-фактора.
Вирулентность — степень патогенности; возможность роста и размножения микобактерий в определенном макроорганизме и способность вызывать специфические патологические изменения в органах. Вирулентным считают штамм микобактерий в том случае, когда он в дозе 0,1 0,01 мг вызывает заболевания туберкулезом, а через 2 месяца — смерть гвинейской свинки массой 250-300 г. Когда после введения этой дозы животное умирает через 5 6 месяцев, то этот штамм считают слабовирулентным. Вирулентность не является неизменным свойством микобактерий. Она снижается при старении культуры или выращивание на искусственных питательных средах и в процессе лечения больных. При пассажах на животных или в случаях обострения туберкулезного процесса вирулентность возрастает.
Носителями генетической информации микобактерий туберкулеза являются хромосомы и внехромосомные элементы — плазмиды. Главное отличие между хромосомами и плазмидами заключается в их размерах. Плазмида сравнению с хромосомой значительно меньше и поэтому несет меньшее количество генетической информации. Именно благодаря своим малым размерам плазмида хорошо приспособлена к перенесению генетической информации из одной микобактериальной клетки в другую.
Плазмиды могут взаимодействовать с хромосомой. Гены устойчивости микобактерий туберкулеза против химиопрепаратов локализуются и в хромосомах, и в плазмидах.
У микобактерии есть ДНК, которая функционирует как главный носитель генетической информации. Последовательность нуклеотидов в молекуле ДНК — это ген. Генетическая информация, которую несет ДНК, не является чем стабильным и неизменным. Она изменчива и эволюционирует, совершенствуясь. Единичные мутации обычно не сопровождаются большими изменениями информации, заложенной в геноме. С одного штамма может возникнуть несколько различных фенотипов (или признаков, проявляющихся в результате действия генов в определенных условиях), которые устойчивы против определенного антимикобактериального препарата.
Мутация может проявляться и в изменении морфологии колоний. Так, если изменить вирулентность микобактерий туберкулеза, то может измениться и морфология колоний мутантов.
Трансдукция — это перенос генетического материала (частицы ДНК) от одной микобактерии (донора) к другой (реципиенту), что приводит к изменению генотипа микобактерии-реципиента.
Трансформация — это включение в хромосому или плазмиду микобактерии (реципиента) фрагмента ДНК другой микобактерии (донора) в результате переноса изолированной ДНК.
Конъюгация — это контакт клеток микобактерии туберкулеза, во время которого происходит переход генетического материала (ДНК) из одной клетки в другую.
Трансфекция — это воспроизведение вирусной формы микобактерии туберкулеза в клетке, которая инфицирована изолированной вирусной нуклеиновой кислотой.
Изложенные гипотетические пути переноса генетической информации еще не изучены. Однако несомненно, что эти генетические процессы являются основой для возникновения лекарственной устойчивости как в отдельных микобактерий, так и у всей бактериальной популяции, имеющейся в организме больного.
Изменчивость микобактерий — это свойство их приобретать новые или / и терять старые признаки. В связи с тем, что у микобактерий туберкулеза короткий период генерации, высокая частота мутаций и рекомбинаций, обмена генетической информацией, изменчивость в них весьма высока и частая (Н. А. Васильев и соавт., 1990).
Различают фенотипическую и генотипическую изменчивости. Фенотипическую мутацию называют еще модификационной, которой свойственна высокая частота изменений и их частая реверсия в исходную форму, адаптация к изменениям внешней среды отсутствие изменений в генетическом коде. Она наследственно не передается.
Генотипическая мутация наступает вследствие мутаций и рекомбинаций.
Мутации — это стабильные унаследованные изменения в нуклеотидном составе генома микобактерии включая плазмиды. Они бывают спонтанные и индуцированные. Спонтанные мутации возникают со специфической для данного гена скоростью. Большинство из них являются следствием ошибок в репликации и репарации ДНК. Индуцированные мутации возможны в результате воздействия мутагенов (ультрафиолетовая; ионизирующая радиация, химические вещества и т.п.). Мутации часто приводят к появлению в фенотипе нового признака или потери старой признаки (по сравнению с родительской формой).
Рекомбинации генетические — это процесс образования потомства, содержащее признаки донор; и реципиента.
Одним из видов изменчивости микобактерий туберкулеза является образование ими фильтрующиеся формы. Это очень мелкие, невидимые при обычной микроскопии формы, имеющие очень слабую вирулентность, их можно обнаружить только при реверсии, используя для этого повторные пассажи на морских свинках. В этих случаях иногда обнаруживают кислотостойкие палочки с очень низкой вирулентностью.
Фильтрующиеся формы — это мелкие фрагменты микобактерий туберкулеза, образующиеся в неблагоприятных условиях существования и способны к реверсии. Природа этих форм, их структура, а также значение в патогенезе туберкулеза до сих пор окончательно не установлено.
L-формы микобактерий туберкулеза имеют или дефекты или отсутствие клеточной стенки. Для них характерна резко измененная морфология бактериальной клетки и пониженный метаболизм. Они имеют низкую вирулентность и быстро разрушаются в окружающей среде. Из-за отсутствия или повреждения оболочки микобактерий туберкулеза L-формы красят обычными красителями, поэтому их не удается выявить бактериоскопически в мазках. Преобразование микобактерий туберкулеза в L-формы происходит под действием противотуберкулезных препаратов, под воздействием защитных сил макроорганизма и других факторов.
L-формы микобактерий туберкулеза могут быть в макроорганизме в стабильном и нестабильном состоянии, то есть реверсировать в исходный микробный вид с восстановлением вирулентности. Вирулентные свойства стабильных L-форм микобактерий резко снижены по сравнению с вирулентностью нестабильных форм.
Нестабильные L-формы микобактерий туберкулеза вызывают у морских свинок генерализованный туберкулез, а стабильные L-формы обусловливают лишь морфологические изменения, близкие к вакцинному процессу. Стабильные L-формы микобактерий преимущественно содержатся в неактивных туберкулезных очагах. Эти очаги способствуют возникновению у здоровых инфицированных людей противотуберкулезного иммунитета.
Для эффективного лечения больных туберкулезом нужно проводить определение чувствительности возбудителя, потому устойчивость против антимикобактеральных препаратов затрудняют лечение. Обычно в организме больного резистентность микобактерий против лекарственных средств может храниться в течение 1-2 лет после их отмены.
Медикаментозная устойчивость микобактерий туберкулеза — это устойчивость МБТ против друга антимикобактериального препарата или более.
Первичная медикаментозная устойчивость — устойчивость, обнаруженная у впервые выявленных больных, которые никогда не принимали противотуберкулезные препараты.
Начальная медикаментозная устойчивость — устойчивость МБТ, выявленная у впервые выявленных больных, леченных противотуберкулезными препаратами не более 4 недель или у больных при отсутствии данных о предшествующем лечении. Вторичная (приобретенная) медикаментозная устойчивость — резистентность МБТ, обнаружена у больных, которым назначали противотуберкулезные препараты более 4 недели. Монорезистентность — устойчивость МБТ против 1 из 5 препаратов I ряда (изониазиду стрептомицина, рифампицина, этамбутола, пиразинамида).
В Украине частота возникновения первичной резистентности возбудителя туберкулеза против препаратов I ряда отмечается в 23-25%, а вторичной — в 55-56% случаев. Множественная лекарственная устойчивость — устойчивость МБТ против двух и больше препаратов. Мультирезистентность — это разновидность множественной лекарственной устойчивости, и именно — устойчивость возбудителя только против комбинации изониазид + рифампицин или и рядом: другими препаратами.
Результат определения чувствительности микобактерий туберкулеза к противотуберкулезным препаратам называется антибиограмой.
Причины лекарственной устойчивости:
1. Биологические — недостаточная концентрация препарата, индивидуальные особенности организма пациента (скорость инактивации препаратов)
2. Причины, обусловленные пациентом — контакт с больными химиорезистентным туберкулез, нерегулярный прием препаратов, преждевременное прекращение приема лекарств, неудовлетворительная переносимость препаратов, проведение неадекватного лечения.
3. Факторы, обусловленные болезнью — при изменении доз препаратов, при большом количестве МБТ в участках пораженного органа может возникать определенная рН, которая препятствует активному действию лекарств, лечение одним препаратом, недостаточная доза или продолжительность лечения.
В последние годы интенсивно проводили генетические исследования штамма М. tuberculosis. Количество гуанинцитозиновых основ, которые распределяются на спирали дезоксирибонуклеиновой кислоты (ДНК), составляет 65,5%. Геном содержит много вставных последовательностей, мультигенных семей, амплифицированных (удвоенных) мест собственного обмена веществ.
РНК-молекулы кодируют около 50 генов, в частности:
- три вида рибосомных РНК, которые синтезируются из уникального рибосомного оперона;
- гены, кодирующие 108-РНК, включается в процесс разрушения белков (выявлено, что эти 108-РНК кодируются так называемыми ненормальными и РНК-мессенджерами);
- гены, кодирующие РНК-компонентную РНКазу Р;
- гены транспортных РНК.
М. tuberculosis имеет 11 рецепторзависимых гистидинкиназ, несколько цитоплазматических киназ и немного генов, участвующих в регуляторных каскадах. В М. tuberculosis является группа эукариотических серинтиреонинових протеинкиназ, отвечающих за фосфорилирование в бактериальной клетке.
Для осуществления липидного обмена в М. tuberculosis синтезируются приблизительно 250 ферментов. Окисление жирных кислот обеспечивают такие ферментные системы:
1. РабА / РабВ-Р-оксидазные комплексы.
2. Тридцать шесть ацил-СоА-синтетаз и группа из тридцати шести ацил-СоА-синтетазсвязанных белков.
3. Пять ферментов, завершают цикл окисления (реакция тиолиза 3 кетоэстеров).
4. Четыре гидроксиацил-СоА-дегидрогеназы.
5. Двадцать один вид белков эноил-СоА-гидратазо-изомеразной группы.
Патогенность М. tuberculosis обусловлена также такими факторами, как:
1) антиоксидазная каталазная-пероксидазная система;
3) МСЭ-оперон, кодирующий белки внутриклеточной инвазии;
5) ферменты, продуцирующие компоненты клеточной стенки;
6) гематоглобиноподобные Ре-связующие белки, которые обеспечивают длительное анаэробное существование микобактерий;
8) значительная антигенная лабильность;
9) наличие различных путей обеспечения антибиотикорезистентности;
10) наличие актериоцинов с цитотоксическим действием (некоторые поликетины).
Возбудитель туберкулеза устойчив к воздействию факторов окружающей среды. На страницах книги микобактерии сохраняются в течение 2-3 мес, в уличной пыли — около 2 недель, в сыре и масле — от 200 до 250 дней, в сыром молоке — 18 дней (скисания молока не вызывает гибели микобактерий), в комнате с рассеянным дневным светом — 1- 5 мес., а в сырых подвальных помещениях и в помойных ямах — до 6 мес.
Оптимальной температурой роста возбудителя является 37-38 ° С, при температуре 42-43 ° С и ниже за 22 ° С рост и размножение его прекращаются. Для птичьего вида микобактерий туберкулеза оптимальной температурой роста является 42 ° С. При температуре 50 ° С микобактерии туберкулеза погибают через 12 ч., 70 ° С — через 1 минуту. В белковой среде их устойчивость значительно повышается. Так, микобактерии туберкулеза в молоке выдерживают температуру 55 ° С в течение 4 ч., 60 ° С — 1 час., 70 ° С — 30 мин., 90 95 ° С — от 3 до 5 минут.
Особенно возрастает устойчивость микобактерий туберкулеза в высохшей мокроте. Чтоб обезвредить жидкое мокроты, их нужно кипятить в течение 5 мин. В высохшей мокроте микобактерии туберкулеза погибают при 100 ° С через 45 минут. В тонком слое жидкой мокроты под влиянием ультрафиолетовых лучей микобактерии туберкулеза погибают через 2-3 мин., а в высохшей мокроте и в темном месте они могут сохранять жизнеспособность в течение 6-12 мес. Однако под воздействием прямого или рассеянного солнечного излучения в течение 4 часов высохшие мокроты теряет свойство вызвать заражение животных туберкулезом. В высохшей на солнце мокроте микобактерии туберкулеза не определяются.
Если мокрота попадает в сточные воды или на поля орошения, микобактерии туберкулеза сохраняют свою вирулентность более 30 дней. На расстоянии 100 м от места сброса сточных вод с противотуберкулезного санатория микобактерии туберкулеза обнаружить не пришлось.
Микобактерии туберкулеза неодинаково устойчивы против воздействия различных дезинфицирующих средств. Так, двойное количество 5% раствора хлорамина убивает микобактерии в мокроте через 6 ч., 2% раствор хлорной извести — через 24-48 ч.
источник
ФТИЗИОПУЛЬМОНОЛОГИЯ / Методматериалы к занятию 1_8 / Методматериалы к занятию 1_7 / Лекарственная устойчивость
ЛЕКАРСТВЕННАЯ УСТОЙЧИВОСТЬ ВОЗБУДИТЕЛЯ ТУБЕРКУЛЕЗА И ПРИЧИНЫ ЕЕ ВОЗНИКНОВЕНИЯ
ОСНОВНЫЕ ОПРЕДЕЛЕНИЯ ПО ЛЕКАРСТВЕННОЙ УСТОЙЧИВОСТИ МБТ
Лекарственно-устойчивый туберкулез (ЛУ-ТБ) — это случай туберкулеза, вызванный штаммом возбудителя туберкулеза, проявляющим in vitro устойчивость к одному или нескольким ПТЛС.
По степени выраженности лекарственной устойчивости выделяют монорезистентность, полирезистентность, множественную лекарственную устойчивость и широкую лекарственную устойчивость возбудителя туберкулеза.
Монорезистентность — лекарственная устойчивость (нечувствительность) МБТ к одному ПТЛС первого ряда.
Полирезистентность — это форма ЛУ-ТБ, которая проявляется устойчивостью к двум и более ПТЛС первого ряда, исключая случай МЛУ-ТБ (то есть, если в перечень устойчивых препаратов не входит одновременно изониазид и рифампицин).
Множественная лекарственная устойчивость (МЛУ) это форма ЛУ-ТБ, при которой микобактерии туберкулеза всегда имеют устойчивость как минимум к изониазиду и рифампицину, с или без устойчивости к другим ПТЛС.
Широкая лекарственная устойчивость (ШЛУ) представляет собой форму МЛУ-ТБ с устойчивостью как минимум к рифампицину и изониазиду, плюс к любому из фторхинолонов, плюс к одному из инъекционных лекарственных средств II ряда (канамицину, амикацину или капреомицину).
Лечение пациентов с ШЛУ-ТБ отличается от алгоритма лечения пациентов с МЛУ-ТБ сложностью в подборе ПТЛС. Выделение ШЛУ-ТБ как отдельной формы обусловлено более тяжелым течением заболевания и худшим прогнозом в сравнении с МЛУ-ТБ.
В зависимости от наличия или отсутствия предыдущего приема ПТЛС выделяют первичную и приобретенную лекарственную устойчивость МБТ.
Лекарственная устойчивость у пациентов, ранее не получавших лечение ТБ (первичная лекарственная устойчивость): устойчивость штамма выделенного от пациента, который ранее никогда не лечился противотуберкулезными лекарственными средствами или лечился меньше одного месяца. Первичный ЛУ-ТБ развивается, если пациент инфицирован резистентными МБТ.
Лекарственная устойчивость у пациентов, ранее получавших лечение ТБ (приобретенная или вторичная лекарственная устойчивость) — это устойчивость МБТ к одному или нескольким ПТЛС, которая регистрируется у пациентов, получавших ранее лечение от туберкулеза продолжительностью не менее 1 месяца. Приобретенный ЛУ-ТБ развивается у пациента, больного ТБ, в процессе неадекватного лечения противотуберкулезными лекарственными средствами.
Продолжение проведения неадекватной химиотерапии пациентов, инфицированных лекарственно-устойчивыми штаммами, вызывает дальнейшее развитие устойчивости к назначенным ПТЛС. Подобный феномен получил название «амплификационный эффект» неадекватной химиотерапии. Пациенты, у которых развилась устойчивость к одному ПТЛС, более подвержены дальнейшему приобретению устойчивости (таким образом, штаммы могут последовательно стать устойчивыми к нескольким лекарственным средствам).
Эпидемиологическое значение пациентов, больных туберкулезом с лекарственной устойчивостью и, особенно, с МЛУ-ТБ, заключается, прежде всего, в том, что они остаются заразными более длительное время, возможности лечения ограничены, и поэтому такие пациенты представляют собой наиболее опасный источник туберкулезной инфекции, в значительной мере определяя уровень инвалидности и смертности от туберкулеза.
ПРИЧИНЫ РАЗВИТИЯ ЛЕКАРСТВЕННОЙ УСТОЙЧИВОСТИ ВОЗБУДИТЕЛЯ ТУБЕРКУЛЕЗА
Факторы (причины) развития ЛУ МБТ
Непосредственные причины развития устойчивости
— несоблюдение инструкции по химиотерапии туберкулеза
— использование нестандартизованных схем химиотерапии или неправильной дозировки ПТЛС
— отсутствие преемственности в проведении химиотерапии туберкулеза между различными ведомствами или противотуберкулезными организациями
— свободный бесконтрольный и безрецептурный доступ к ПТЛС, нерегулярные поставки, плохое качество лекарств или неправильное их хранение
— запоздалое выявление лекарственно- устойчивого ТБ, что приводит к продлению сроков передачи инфекции, заражению и заболеванию окружающих первичным ЛУ- ТБ
— отсутствие или низкое качество работы бактериологической лаборатории, проводящей тестирование на наличие ЛУ МБТ, и проведение лечения не в соответствии с ТЛЧ
— недостаточная санитарно-просветительная работа с пациентами
— неквалифицированный подбор схемы химиотерапии
— нарушение всасывания лекарственных средств в кишечнике
— наличие большого удельного веса среди пациентов, больных ТБ, социально-дезадаптированных лиц, с трудностями в завершении курса лечения
— пациенты, больные хроническим алкоголизмом и наркоманиями, которые не соблюдают предписанный режим лечения, и когда лечение под непосредственным контролем не обеспечено
источник
Микобактериями туберкулеза в ходе эволюционного развития были выработаны механизмы защиты от факторов внешней среды, такие как толстая клеточная стенка, богатые метаболические возможности, которые способны обезвреживать многие клеточные токсины и вещества (альдегиды, перекиси), повреждающие клеточную стенку, также можно упомянуть способность к трансформации(переход в L-форму, образование доминантных клеток) [8].
Выделяют несколько классификаций лекарственной устойчивости микобактерии туберкулеза:
I. По чувствительности к противотуберкулезным препаратам [6, 8]
Истинная генетическая устойчивость – это видовой признак микроорганизмов, который связан с отсутствием точки приложения антибиотика с МБТ, ее недоступностью из-за плохой проницаемости клеточной стенки или разрушения ферментами.
МБТ обладают истинной генетической устойчивостью ко многим неспецифическим антимикробным препаратам, относящимся к семействам пенициллинов, β-лактамов, макролидов, карбапенемов, цефалоспоринов, тетрациклинов. Однако чувствительны к аминогликозидам (стрептомицин, канамицин, амикацин), полипептидам (капреомицин), рифампицинам (рифампицин, рифабутин) и фторхинолонам (ципрофлоксацин, ломефлоксацин, офлоксацин, левофлоксацин, моксифлоксацин, спарфлоксацин) [5].
Приобретенная лекарственная устойчивость МБТ проявляется в возможности размножаться при воздействии на них противотуберкулезных препаратов по средствам развития точечных мутаций [7] в хромосомах и формировании новых генов, контролирующих синтез новых белков-ферментов, разрушающих или инактивирующие конкретные противотуберкулезные препараты. Приобретенную лекарственную устойчивость подразделяют на первичную и вторичную. Первичная ЛУ определяется у больных, заразившихся лекарственно-устойчивыми МБТ. Эти пациенты ранее не принимали противотуберкулезные препараты [6]. Вторичная ЛУ развивается в процессе самого лечения больного туберкулезом. Устойчивость МБТ развивается через 3-6 месяцев с начала лечения [6].
II. По спонтанности возникновения мутаций (спонтанные и индуцированные)
В большой и активно размножающейся микобактериальной популяции всегда имеется небольшое количество лекарственно-устойчивых спонтанных мутантов в соотношениях:
1 клетка-мутант на 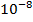
1 клетка-мутант на 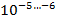
1 клетка-мутант на 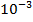
С учётом того что в каверне величина микобактериальной популяции составляет 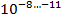
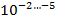
При экзогенной (индуцированной) ЛУ происходит естественный отбор в пользу мутантов с естественной ЛУ к противотуберкулезным препаратам. В дальнейшем это приводит к изменению в геноме, что приводит к увеличению бактериальной популяции с лекарственно-устойчивыми микобактериями. Этому способствует проведение неадекватной химиотерапии, при этом пациенту назначается неправильный режим, несбалансированное сочетание и дозы противотуберкулезных лекарственных средств [6].
По эпидемиологической классификации ВОЗ (2008) МБТ могут быть:
— монорезистентными (МР) – к одному противотуберкулезному препарату;
— полирезистентными (ПР) – к двум и более противотуберкулезным препаратам, но не к сочетанию изониазида и рифампицина;
— множественно лекарственно-устойчивыми (МЛУ) – как минимум к сочетанию изониазида и рифампицина. Такие больные обладают высокой эпидемиологической опасностью вследствие высокой вирулентности и контагиозности, длительного периода бактериовыделения. К группам повышенного риска относятся ВИЧ-инфицированные больные и ранее неправильно лечившиеся пациенты с туберкулезом [4]. При анализе заболеваемости туберкулёзом среди ВИЧ-инфицированных г. Краснокамска была выявлена МЛУ у 60% больных с впервые выявленным туберкулезом [1].
— широко лекарственно-устойчивыми (ШЛУ) – как минимум к сочетанию изониазида, рифампицина, фторхинолонов и инъекционных препаратов (канамицина, амикацина, капреомицина). Так как ШЛУ проявляет ЛУ к препаратам I ряда, а противотуберкулезные препараты II ряда не обладают выраженным антибактериальным действием, то можно утверждать, что такие штаммы опасны для жизни пациентов [4].
Генетические основы резистентности ко многим антибиотикам изучены недостаточно хорошо. По имеющимся данным в приобретении лекарственно-устойчивого фенотипа МБТ плазмиды и траспозоны особой роли не играют. Причиной возникновения лекарственно-устойчивых штаммов являются точечные мутации [7] и небольшие инсерции/делеции в геноме микроорганизма [2, 3].
Выделяют следующие механизмы лекарственной устойчивости микобактерий туберкулёза [8]: инактивация антибиотика ферментами, (например, β-лактамазами); изменение мишени (в результате мутации соответствующего участка генома происходит модификация белковой структуры); избыточное образование мишени, которое приводит к нарушению соотношения агент-мишень, в результате чего высвобождаются белки, необходимые для жизнедеятельности бактерии; выведение лекарственного вещества из бактериальной клетки (эффлюкс) по средствам включения стрессорных механизмов защиты; уменьшение проницаемости клеточной стенки, вследствие чего антибиотик не может проникнуть внутрь бактерии; появление дополнительного (обходного) пути обмена веществ.
Помимо прямого воздействия на метаболизм микробных клеток многие антибактериальные препараты (бензилпенициллин. стрептомицин, рифампицин) и другие неблагоприятные факторы (биоциды иммунной системы) приводят к появлению изменённых форм микобактерий (протопласты, L-формы), а также переводят клетки в дормантное состояние: интенсивность обмена клетки снижается и бактерия становится невосприимчивой к действию антибиотика [8].
Выделяют основные противотуберкулезные препараты I ряда: рифампицин, изониазид, этамбутол, стрептомицин, пиразинамид. Препараты II ряда являются резервными и используются для лечения полирезистентного туберкулеза, к ним относятся: этионамид, циклосерин, канамицин, виомицин, амикацин и др. [3, 5]
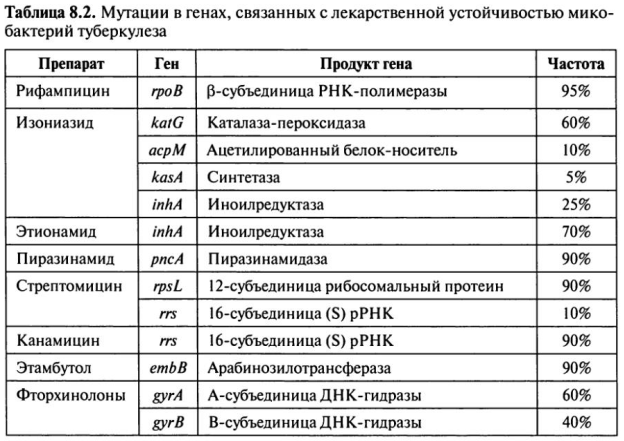
Механизм рифампицина основан на взаимодействии с β-субъединицей РНК-полимеразы (ген rpoB), в результате чего происходит ингибирование инициации транскрипции. МБТ устойчивы к рифампицину благодаря мутации в фрагменте β-субъединицы (27 кодонов – 507-533) этого фермента (более 95%штаммов). При мутации в кодонах 526 (36%) и 531 (43%) [3, 10] обнаруживают высокий уровень резистентности к антибиотику, в то время как, в кодонах 511, 516, 518 и 522 – низкий. У 4%штаммов механизм резистентности неизвестен, так как они не несут мутаций в данном гене [3, 6].
Изониазид является пролекарством. Молекула препарата активируется внутри микробной клетки под действием фермента каталазы-пероксидазы (ген katG). Мутации в гене katG (в положении 315) приводят к снижению активности фермента примерно на 50%. Также ферменты, участвующие в метаболизме миколевой кислоты (основной компонент клеточной стенки МБТ), являются мишенями для активированного изониазида: ацетилированный белок-носитель (ген acpM), синтетаза (ген kasA) и редуктаза (ген inhA) белка-носителя. Мутации, возникшие в этих генах, вызывают устойчивость, связанную с гиперпродукцией мишеней. Уровень устойчивости при этом ниже, чем при мутации в гене katG [3, 10].
О механизмах действия пиразинамида известно мало. Он также является пролекарством. Пиразинамид по средствам пассивной диффузии проникает в бактериальную клетку, где под действием фермента пиразинамидазы переходит в активную форму – пиразиноевую кислоту (ген pncA), которая блокирует ферменты биосинтеза жирных кислот. 72% изолятов, устойчивых к пиразинамиду, имеют мутации в гене pncA. У пиразинамидустойчивых МБТ выявляют также отсутствие АТФ-зависимого транспорта этого препарата в клетку [3, 6].
Стрептомицин приводит к ингибированию синтеза белка, связываясь с 16S рРНК (rrs). Мутации, ассоциированные с устойчивостью к стрептомицину, идентифицированы в генах, кодирующих 16S РНК (rrs) и белок малой рибосомной субъединицы 12S (rpsL). Есть данные о мутации, которая ведет к повышению устойчивости МБТ к стрептомицину – эти штаммы плохо растут, пока в их питательную среду не добавить данный антибиотик (стрептомицинзависимые штаммы) [6].
Этамбутол осуществляет свое влияние через белок embB (арабинозилотрансфераза), принимающий участие в синтезе структурных элементов клеточной стенки МБТ. Устойчивость к этому препарату появляется вследствие точечной мутации в 306-м кодоне [10].
Этионамид (протионамид) также способствует появлению мутаций в гене inhA, поэтому резистентность к этионамиду иногда возникает вместе с резистентностью к изониазиду, так как эти препараты имеют общего предшественника – никотинамид. Этионамид является пролекарством и для его активирования необходим фермент, который в настоящее время еще не установлен [3, 6].
Канамицин (амикацин) вызывает мутации в 16S рРНК (1400 позиция) – замена аденина на гуанин [6].
Фторхинолоны вызывают мутации в генах gyrA и gyrB ДНК-гиразы. Вследствие этого нарушается процесс репликации ДНК [9].
Представленная информация призвана способствовать формированию целенаправленной деятельности для контроля лекарственной устойчивости в интересах совершенствования лечебно-профилактических мероприятий у больных туберкулезом.
источник