10. Лекарственная устойчивость мбт, механизм развития. Виды лекарственной устойчивости мбт, значение в клинике.
Важным признаком изменчивости МБТ . является устойчивость к одному или нескольким противотуберкулезным препаратам. Виды лекарственной устойчивости:
— первичная — устойчивость МБТ к противотуберкулезным препаратам(ПТП) у больных туберкулезом, которые ранее не получали специфической терапии.
— начальная — устойчивость МБТ к ПТП у больных туб., которые ранее могли их получать. Включает
первичную и не выявленную приобретенную.
— приобретенная (вторичная) -устойчивость у больных , которым ранее проводилась специфическая терапия.
— монорезистснтность — устойчивость к одному ПТП.
— полирезистснтносгь — устойчивость к двум и более ПТП, но не к сочетанию изониазида и рифампицина.
— множественная — -//- + сочетание изониазида и рифампицина
— перекрестная (полная и неполная)
Основные механизмы развития лекарственной устойчивости
Поэтому для химиотерапии применяют не менее 4-х препаратов; если препарат = 40 мкг/мл и МБТ устойчива—что нужно исключать.
Методы определения лекарственной устойчивости
1 .Классические: -м-д пропорций
-м-д коэффициента устойчивости -м-д абсолютных концентраций
-радиометрический м-д системы ВАС ГЕС
На внедрение микобактерий в организм, в нем возникают ответные (защитные) реакции, что обусловлено воздействием специфических и неспецифических факторов защиты:
1 .Неспецифическая защита: в первую очередь лишена специфичности и непосредственно на тбк не действует. Представлена:
• клеточный компонент: лейкоциты, макрофаги — обеспечивают фагоцитоз, препятствуют распространению тбк;
• гуморальный компонент: интерферон, лизоцим, комплемент. AT передаются трансплацентарно. Неспецифическая защита не способна распознать вторично поступающих микобактерий, не способна уничтожить и запомнить AT тбк, но на основе неспецифической формируется специфическая.
2.Специфическая — формируется на основе неспецифической, представлена иммунными реакциями на основе иммунокомпетентных органов (центральных и периферических). Основную клинику обеспечивают Т и В лимфоциты. После контакта лимфоцитов с тбк они становятся активированными и формируют иммунный ответ.
При первом проникновении — микобактерий фагоцитируют нейтрофилы или макрофаги, в них микобактерии не разрушаются (возможно выделение клеток). Информация о контакте передается Т и В лимфоцитам через РНК либо через АГ, далее они трансформируются либо в Т2 клетки, либо в субпопуляции В-клеток.
В-клетки, плазмоциты, иммуноглобулин М на Т-лимфоцитарную систему ; пассивные рецепторы на Т- клетках (активируют Т-лимфоциты, а макрооргангизмы сенсибилизируют). Т-активированные лимфоциты лимфокины(бактериостатическое действие, реактивный фактор, учакстник некроза, снижает пролиферацию других клеток). Каждый лимфокин имеет свой антагонист. Т-активированные лимфоциты взаимодействуют с макрофагами (-*- ингибиция, перемещение макрофагов, + индукция превращения в эпителиальную гигантскую клетку, t макрофаги выделяют монокины). Феномен гиперчувствительности замедленного типа зависит от Т-лимфоцитов.
Местные реакции: образование классической тбк гранулемы (барьерная функция), перифокальное воспаление вокруг гранулемы.
Общие реакции: параспецифические (гистиоцитарная и лимфоцитарная инфильтрации вокруг сосудов), аллергические (способность макроорганизма отвечать воспалительной реакцией на повторное проникновение микобактерий гбк..
Развивается медленно, начало 8-24 часа от момента контакта и заканчивается в течении 4-6 часов. Стадии:
• натохимическая (выделение лимфокинов)
• патофизиологическая (воспалительная) Возникают остаточные иммуноглобулины.
AT образуются к различным фракциям микобактерий тбк (полисахариды, фосфатиды, гликопептиды). Действие AT различно:
AT к факторам вирулентности очень токсичны
AT к протеинам могут блокировать эффекторные механизмы иммунного ответа AT к полисахаридам способны увеличивать фагоцитоз.
• увеличение титров может неблагоприятно влиять на течение тбк (повреждаются ткани) уменьшение титра — ослабление организма.
AT не идеальная защита от тбк, особенно когда микобактерии располагаются внеклегочно; гуморальный иммунитет имеет вторичное значение. Иммунитет: контактный, инфекционный, приобретенный, клеточно-гуморальный. При вторичном попадании тбк гранулема образуется в 1.5-2 раза быстрее, увеличение сопративляемости ткани, ферменты быстро разрушают микобактерию. Иммунитет может быть относительный; нестойкий — заболевание возможно.
источник
ФТИЗИОПУЛЬМОНОЛОГИЯ / Методматериалы к занятию 1_8 / Методматериалы к занятию 1_7 / Лекарственная устойчивость
ЛЕКАРСТВЕННАЯ УСТОЙЧИВОСТЬ ВОЗБУДИТЕЛЯ ТУБЕРКУЛЕЗА И ПРИЧИНЫ ЕЕ ВОЗНИКНОВЕНИЯ
ОСНОВНЫЕ ОПРЕДЕЛЕНИЯ ПО ЛЕКАРСТВЕННОЙ УСТОЙЧИВОСТИ МБТ
Лекарственно-устойчивый туберкулез (ЛУ-ТБ) — это случай туберкулеза, вызванный штаммом возбудителя туберкулеза, проявляющим in vitro устойчивость к одному или нескольким ПТЛС.
По степени выраженности лекарственной устойчивости выделяют монорезистентность, полирезистентность, множественную лекарственную устойчивость и широкую лекарственную устойчивость возбудителя туберкулеза.
Монорезистентность — лекарственная устойчивость (нечувствительность) МБТ к одному ПТЛС первого ряда.
Полирезистентность — это форма ЛУ-ТБ, которая проявляется устойчивостью к двум и более ПТЛС первого ряда, исключая случай МЛУ-ТБ (то есть, если в перечень устойчивых препаратов не входит одновременно изониазид и рифампицин).
Множественная лекарственная устойчивость (МЛУ) это форма ЛУ-ТБ, при которой микобактерии туберкулеза всегда имеют устойчивость как минимум к изониазиду и рифампицину, с или без устойчивости к другим ПТЛС.
Широкая лекарственная устойчивость (ШЛУ) представляет собой форму МЛУ-ТБ с устойчивостью как минимум к рифампицину и изониазиду, плюс к любому из фторхинолонов, плюс к одному из инъекционных лекарственных средств II ряда (канамицину, амикацину или капреомицину).
Лечение пациентов с ШЛУ-ТБ отличается от алгоритма лечения пациентов с МЛУ-ТБ сложностью в подборе ПТЛС. Выделение ШЛУ-ТБ как отдельной формы обусловлено более тяжелым течением заболевания и худшим прогнозом в сравнении с МЛУ-ТБ.
В зависимости от наличия или отсутствия предыдущего приема ПТЛС выделяют первичную и приобретенную лекарственную устойчивость МБТ.
Лекарственная устойчивость у пациентов, ранее не получавших лечение ТБ (первичная лекарственная устойчивость): устойчивость штамма выделенного от пациента, который ранее никогда не лечился противотуберкулезными лекарственными средствами или лечился меньше одного месяца. Первичный ЛУ-ТБ развивается, если пациент инфицирован резистентными МБТ.
Лекарственная устойчивость у пациентов, ранее получавших лечение ТБ (приобретенная или вторичная лекарственная устойчивость) — это устойчивость МБТ к одному или нескольким ПТЛС, которая регистрируется у пациентов, получавших ранее лечение от туберкулеза продолжительностью не менее 1 месяца. Приобретенный ЛУ-ТБ развивается у пациента, больного ТБ, в процессе неадекватного лечения противотуберкулезными лекарственными средствами.
Продолжение проведения неадекватной химиотерапии пациентов, инфицированных лекарственно-устойчивыми штаммами, вызывает дальнейшее развитие устойчивости к назначенным ПТЛС. Подобный феномен получил название «амплификационный эффект» неадекватной химиотерапии. Пациенты, у которых развилась устойчивость к одному ПТЛС, более подвержены дальнейшему приобретению устойчивости (таким образом, штаммы могут последовательно стать устойчивыми к нескольким лекарственным средствам).
Эпидемиологическое значение пациентов, больных туберкулезом с лекарственной устойчивостью и, особенно, с МЛУ-ТБ, заключается, прежде всего, в том, что они остаются заразными более длительное время, возможности лечения ограничены, и поэтому такие пациенты представляют собой наиболее опасный источник туберкулезной инфекции, в значительной мере определяя уровень инвалидности и смертности от туберкулеза.
ПРИЧИНЫ РАЗВИТИЯ ЛЕКАРСТВЕННОЙ УСТОЙЧИВОСТИ ВОЗБУДИТЕЛЯ ТУБЕРКУЛЕЗА
Факторы (причины) развития ЛУ МБТ
Непосредственные причины развития устойчивости
— несоблюдение инструкции по химиотерапии туберкулеза
— использование нестандартизованных схем химиотерапии или неправильной дозировки ПТЛС
— отсутствие преемственности в проведении химиотерапии туберкулеза между различными ведомствами или противотуберкулезными организациями
— свободный бесконтрольный и безрецептурный доступ к ПТЛС, нерегулярные поставки, плохое качество лекарств или неправильное их хранение
— запоздалое выявление лекарственно- устойчивого ТБ, что приводит к продлению сроков передачи инфекции, заражению и заболеванию окружающих первичным ЛУ- ТБ
— отсутствие или низкое качество работы бактериологической лаборатории, проводящей тестирование на наличие ЛУ МБТ, и проведение лечения не в соответствии с ТЛЧ
— недостаточная санитарно-просветительная работа с пациентами
— неквалифицированный подбор схемы химиотерапии
— нарушение всасывания лекарственных средств в кишечнике
— наличие большого удельного веса среди пациентов, больных ТБ, социально-дезадаптированных лиц, с трудностями в завершении курса лечения
— пациенты, больные хроническим алкоголизмом и наркоманиями, которые не соблюдают предписанный режим лечения, и когда лечение под непосредственным контролем не обеспечено
источник
10) Лекарственная устойчивость мбт, механизм развития. Виды лекарственной устойчивости мбт, значение в клинике.
Важным признаком изменчивости МБТ . является устойчивость к одному или нескольким противотуберкулезным препаратам. Виды лекарственной устойчивости:
— первичная — устойчивость МБТ к противотуберкулезным препаратам(ПТП) у больных туберкулезом, которые ранее не получали специфической терапии.
— начальная — устойчивость МБТ к ПТП у больных туб., которые ранее могли их получать. Включает
первичную и не выявленную приобретенную.
— приобретенная (вторичная) -устойчивость у больных , которым ранее проводилась специфическая терапия.
— монорезистснтность — устойчивость к одному ПТП.
— полирезистснтносгь — устойчивость к двум и более ПТП, но не к сочетанию изониазида и рифампицина.
— множественная — -//- + сочетание изониазида и рифампицина
— перекрестная (полная и неполная)
Основные механизмы развития лекарственной устойчивости
Поэтому для химиотерапии применяют не менее 4-х препаратов; если препарат = 40 мкг/мл и МБТ устойчива—что нужно исключать.
Методы определения лекарственной устойчивости
1 .Классические: -м-д пропорций
-м-д коэффициента устойчивости -м-д абсолютных концентраций
-радиометрический м-д системы ВАС ГЕС
На внедрение микобактерий в организм, в нем возникают ответные (защитные) реакции, что обусловлено воздействием специфических и неспецифических факторов защиты:
1 .Неспецифическая защита: в первую очередь лишена специфичности и непосредственно на тбк не действует. Представлена:
• клеточный компонент: лейкоциты, макрофаги — обеспечивают фагоцитоз, препятствуют распространению тбк;
• гуморальный компонент: интерферон, лизоцим, комплемент. AT передаются трансплацентарно. Неспецифическая защита не способна распознать вторично поступающих микобактерий, не способна
уничтожить и запомнить AT тбк, но на основе неспецифической формируется специфическая. 2.Снецифическая — формируется на основе неспецифической, представлена иммунными реакциями на основе иммунокомпетентных органов (центральных и периферических). Основную клинику обеспечивают Т и В лимфоциты. После контакта лимфоцитов с тбк они становятся активированными и формируют иммунный о твет.
При первом проникновении — микобактерий фагоцитируют нейтрофилы или макрофаги, в них микобактерии не разрушаются (возможно выделение клеток). Информация о контакте передается Т и В лимфоцитам через РНК либо через АГ, далее они трансформируются либо в Т2 клетки, либо в субпопуляции В-клеток.
В-клетки, плазмоциты, иммуноглобулин М на Т-лимфоцитарную систему ; пассивные рецепторы на Т- клетках (активируют Т-лимфоциты, а макрооргангизмы сенсибилизируют). Т-активированные лимфоциты лимфокины(бактериостатическое действие, реактивный фактор, учакстник некроза, снижает пролиферацию других клеток). Каждый лимфокин имеет свой антагонист. Т-активированные лимфоциты взаимодействуют с макрофагами (-*- ингибиция, перемещение макрофагов, + индукция превращения в эпителиальную гигантскую клетку, t макрофаги выделяют монокины). Феномен гиперчувствительности замедленного типа зависит от Т-лимфоцитов.
Местные реакции: образование классической гбк гранулемы (барьерная функция), перифокальное воспаление вокруг гранулемы.
Общие реакции: параспецифические (гистиоцитарная и лимфоцитарная инфильтрации вокруг сосудов), аллергические (способность макроорганизма отвечать воспалительной реакцией на повторное проникновение микобактерий гбк..
Развивается медленно, начало 8-24 часа от момента контакта и заканчивается в течении 4-6 часов. Стадии:
источник
Особенную тревогу у врачей фтизиатров вызывает широкое распространение серьезной формы заболевания под названием множественная лекарственная устойчивость при туберкулезе или МЛУ-ТБ. Что это значит? Ответ можно найти в предлагаемой статье.
Данный вид туберкулезной инфекции характеризуется отсутствием эффективности использования самых действенных препаратов, способных противостоять пагубному воздействию на организм палочки Коха.
Основным фактором, способствующими развитию устойчивости микобактерий туберкулеза к сильнейшим препаратам, используемым при лечении инфекции, считается нарушение пациентами рекомендаций относительно приема лекарств. Это нерегулярность или неправильная дозировка.
В большинстве случаев подобное отношение приводит к ситуации, когда самые эффективные медикаментозные средства не справляются с болезнетворными бактериями, что ставит под угрозу жизнь пациента.
Способность бактерий туберкулеза противостоять воздействию исключительно сильных лекарственных препаратов обуславливается многообразием факторов, основным их которых является неверный подход к их использованию.
Формирование устойчивости микобактерий является результатом их хромосомной мутации, вызванной отсутствием чувствительности некоторых из них к лекарственным средствам или нарушением концентрации используемого препарата. В этом случае погибают не все бактерии, выжившие наследуют резистентность к препаратам.
Среди других факторов, способствующих приобретению микобактериями устойчивой формы, следует отметить:
- Отсутствие своевременного выявления наличия у пациента первичной устойчивости к препаратам.
- Преждевременное прекращение лечения, прерывание курса.
- Несвоевременный и нерегулярный прием лекарства.
- Уменьшение предписанной дозировки.
- Низкое качество препаратов.
- Отсутствие проверки сочетаемости и эффективности используемых медикаментозных средств.
- Допущение ошибки в выборе схемы лечения.
Возникновение перекрестной резистентности, когда устойчивость к одному из используемых препаратов может спровоцировать отсутствие чувствительности и к другому.
Устойчивость возбудителя инфекции зачастую является следствием халатного отношения пациента, прекращающего прием медикаментов при улучшении самочувствия до окончания полного курса терапии. Рецидив туберкулеза способствует его прогрессированию, но уже в устойчивой форме.
Среди других причин следует отметить ошибки врачей и отсутствие необходимых препаратов.
Классификация проявления устойчивости возбудителя инфекции к медикаментозному лечению выделяет три категории. В каждой из них рассматриваются определенные химиопрепараты, на которые у микобактерий вырабатывается резистентность (устойчивость).
Отличительной особенностью туберкулеза с множественной лекарственной устойчивостью является отсутствие возможности вылечить его сильнейшими препаратами, эффективными при терапевтическом воздействии на обычный туберкулез, хотя возбудителем инфекции является одна и та же палочка Коха.
Это основные и наиболее мощные противотуберкулезные химиопрепараты первого ряда — Рифампицин и Изониазид. Они признаны самыми эффективными в борьбе с туберкулезом, однако при наличии МЛУ они не могут уничтожить палочку Коха даже без проявления устойчивости к препаратам другого ряда.
Множественная лекарственная устойчивость с трудом поддается лечению, что объясняется исключительной агрессивностью и живучестью микобактерий, утративших чувствительность к препаратам противотуберкулезной направленности.
В отличие от МЛУ при туберкулезе с широкой лекарственной устойчивостью наблюдается отсутствие чувствительности не только к Иониазиду и Рифампицину, но и ко всем представителям фторхинолонов, относящихся к препаратам второго ряда противотуберкулезных средств. Кроме этого данная форма туберкулеза обладает устойчивостью к медикаментам 3 ряда (Капреомицину, Амикацину и Канамицину), что в значительной степени затрудняет выбор тактики лечения.
Следует признать, что данный термин наиболее точно характеризует туберкулез, сопровождающийся проявлением резистентности палочки Коха ко всем противотуберкулезным препаратам.
Подобное отсутствие чувствительности микобактерий возникает вследствие мутации или упущений в ходе лечения патологии. В этом случае лечение пациента весьма затруднено и зачастую становится причиной летального исхода.
Кроме перечисленных видов заболевания необходимо учитывать возможность проявления:
- Первичной устойчивости микобактерий, при которой инфицирование пациента произошло от больного, являющегося носителем устойчивой бактерии.
- Приобретенной устойчивости, возникшей через определенный период после начала терапевтического курса.
- Монорезистентности – к одному какому-то лекарству.
- Полирезистентности – одновременно к нескольким препаратам.
Мультирезистентный туберкулез, сопровождающийся повышенной устойчивостью микобактерий к лекарственным противотуберкулезным средствам, характеризуется не только слабой эффективностью терапевтического воздействия на возбудителя инфекции, но и высокой вероятностью летального исхода. Лечение такой формы заболевания отличается сложностью и длительностью.
О подозрении на множественную лекарственную устойчивость можно говорить в следующих ситуациях:
- если не наблюдается улучшение от терапевтического лечения;
- если туберкулезный процесс прогрессирует, несмотря на регулярный прием лекарственных средств;
- если продолжается выделение микобактерии.
На начальном этапе туберкулеза определить наличие лекарственно устойчивой формы удается только с помощью специального тестирования.
Определение вида МЛУ является важным этапом комплексного подхода и определяющим фактором в выборе схемы терапии.
Медикаментозное терапевтическое воздействие предусматривает использование различных комбинаций химиопрепаратов 1 и 2 ряда. Кроме этого при тяжелом течении заболевания допускается использование лекарственной группы, относящейся к 3 ряду.
Среди непреложных принципов воздействия лекарственных средств на туберкулезную палочку следует учитывать следующие:
- адекватный выбор средств;
- комплексный подход к использованию препаратов;
- непрерывность терапевтического курса;
- систематический контроль медицинских работников над соблюдением правил приема лекарственных средств.
Кроме этого лекарственно устойчивый туберкулез предусматривает проведение терапевтического курса согласно стандартным схемам с учетом подбора эффективных средств, дозировки, соответствующего режима и продолжительности лечения.
Принципиально важными требованиями при лечении пациентов с множественной лекарственной устойчивостью становятся:
- Применение единовременного использования 5 противотуберкулезных препаратов, не утративших чувствительность к выявленным микобактериям. В зависимости от степени тяжести допускается назначение дополнительных средств.
- Использование максимальной дозировки с целью эффективного воздействия на бактерии туберкулеза.
- Обязательное продолжение курса антибиотиков на протяжении полугода после момента, свидетельствующего об отсутствии микобактерий в организме пациента.
- Общая продолжительность лечения после выздоровления составляет от полутора года до двух лет, несмотря на полученные отрицательные результаты.
- В отличие от обычной формы туберкулеза, предусматривающей одноразовое применение медикаментов в сутки, больной с МЛУ при туберкулезе получает лекарства в 2 или 3 приема на протяжении 24 часов. Процедура проходит под обязательным контролем медиков.
Обязательным условием является строгий учет пациентов и их официальное согласие на предложенную схему терапии.
Использование лекарств из 2 и 3 ряда провоцирует проявление большого количества побочных эффектов. Это:
- общее недомогание;
- позывы к рвоте, тошнота;
- плохой аппетит;
- снижение слуха;
- присутствие боли в суставах;
- нервное напряжение, тревожность, головокружение.
Подобные симптомы характерны в основном для начального этапа лечебного курса. Но оставлять их без внимания не следует. Необходимо сообщить об этом врачу. Он скорректирует дозировку или подберет аналогичный препарат.
Прерывать лечение не следует, так как это приведет к еще большей агрессивности и устойчивости микобактерий, и лечить туберкулез будет еще сложнее.
Характерная ошибка, приводящая к устойчивости туберкулезной палочки, — это ситуация, при которой пациент при улучшении состояния считает, что окончательно вылечился и прекращает прием лекарств.
В результате возобновление лечебного курса не дает положительных результатов вследствие развития мультирезистентной устойчивости микобактерий.
Подобрать эффективные препараты в таком случае уже не представляется возможным. Это вызывает необходимость хирургического удаления пораженного органа.
Исход операции предсказать трудно. При этом после нее сохраняется необходимость в дальнейшем терапевтическом воздействии во избежание рецидива туберкулезного процесса. Однако подбор действенных препаратов в значительной мере осложняется и даже становится практически невозможным, что приводит к неминуемой смерти пациента.
Предупредить вероятность развития МЛУ при туберкулезе удается только в случае неукоснительного следования основным принципам лечения. С этой целью пациенту следует настроиться на сложный и длительный курс терапии, а также строгое выполнение указаний врача.
источник
Чувствительными к данному препарату считаются те штаммы микобактерий, на которые этот препарат в критической концентрации (критерий устойчивости) оказывает бактерицидное или бактериостатическое действие.
Устойчивость (резистентность) определяется как снижение чувствительности до такой степени, что данный штамм микобактерий способен размножаться при воздействии на него препарата в критической или более высокой концентрации.
Наряду с понятиями чувствительности и устойчивости к противотуберкулезным препаратам в настоящее время используются также термины, определяющие количественную и качественную стороны лекарственной устойчивости.
Приобретенная (вторичная) резистентность — это такие случаи туберкулеза, когда штаммы МБТ превращаются из чувствительных в устойчивые фенотипы в процессе или после курса химиотерапии. Неэффективная химиотерапия туберкулеза способствует селекции лекарственно-устойчивых мутантов МБТ.
Наличие приобретенной резистентности подозревается у больных, имеющих в анамнезе указания на лечение противотуберкулезными препаратами в течение 1 мес или более, при этом первоначально было известно, что в начале терапии данный штамм МБТ был чувствителен к противотуберкулезным препаратам.
Первичная резистентность. В некоторых случаях у больных при начальном обследовании выявляются штаммы МБТ, имеющие выраженную резистентность к одному или нескольким противотуберкулезным препаратам.
Первичная резистентность имеет место, когда человек инфицирован МБТ, уже будучи резистентными к одному или большему количеству противотуберкулезных препаратов.
Комбинированная резистентность. Определение, принятое Всемирной организацией здравоохранения, суммирует первичную и приобретенную резистентность для определения ее распространенности.
Монорезистентность. Штаммы МБТ резистентны только к одному из пяти противотуберкулезных препаратов первого ряда (рифампицин, изониазид, этамбутол, пиразинамид, стрептомицин).
Множественная лекарственная устойчивость (МЛУ) МБТ к действию изониазида и рифампицина одновременно, с наличием или без наличия устойчивости к любым другим противотуберкулезным препаратам.
Полирезистентность(сложная комбинационная резистентность) — это устойчивость МБТ к любым двум противотуберкулезным препаратам и более без одновременной устойчивости к изониазиду и рифампицину.
Мультирезистентные микобактерии туберкулеза, или мультирезистентный туберкулез (МРТ) — наиболее опасная форма бактериальной резистентности в настоящее время. МРТ вызывает серьезную озабоченность при борьбе с туберкулезом во многих странах.
Начиная с 90-х г. прошлого века отмечено несколько вспышек МРТ в различных регионах мира как следствие неправильного использования противотуберкулезных препаратов. Обычно МРТ возникает при хроническом туберкулезе, отсутствии эффекта от стандартной схемы химиотерапии, предложенной ВОЗ, или других схем лечения и составляет существенную долю больных туберкулезом с приобретенной резистентностью.
Уровень устойчивости данного штамма в целом выражается той максимальной концентрацией препарата (количество микрограммов в 1 мл питательной среды), при которой еще наблюдается размножение микобактерий (по числу колоний на плотных средах).
Для различных препаратов установлена определенная концентрация (критическая), имеющая клиническое значение, при которой еще наблюдается размножение чувствительных к этому препарату микобактерий.
Для определения лекарственной устойчивости микобактерий наиболее распространенным является метод абсолютных концентраций на плотной яичной питательной среде Левенштейна-Йенсена.
Лекарственно-устойчивые микроорганизмы способны размножаться при таком содержании препарата в среде, которое оказывает на чувствительные особи бактериостатическое или бактерицидное воздействие.
источник

К микроорганизмам с первичной устойчивостью относят штаммы, выделенные от пациентов, не получавших ранее специфическую терапию или получавших препараты в течение месяца или меньше.
При невозможности уточнения факта применения противотуберкулёзных препаратов используют термин «начальная устойчивость».
Если устойчивый штамм выделен у пациента на фоне противотуберкулёзной терапии, проводимой в течение месяца и более, устойчивость расценивают как «приобретённую». Частота первичной лекарственной устойчивости характеризует эпидемиологическое состояние популяции возбудителя туберкулёза.
Приобретённая лекарственная устойчивость среди впервые выявленных больных считается результатом неудачного лечения — то есть действовали факторы, приводящие к снижению системной концентрации химиопрепаратов в крови и их эффективности, одновременно «запуская» в клетках микобактерий защитные механизмы.
В структуре лекарственной устойчивости микобактерий туберкулёза различают:
- Монорезистентность — устойчивость к одному из противотуберкулёзных препаратов, чувствительность к другим препаратам сохранена. При применении комплексной терапии монорезистентность выявляют довольно редко и, как правило, к стрептомицину (в 10—15 % случаев среди впервые выявленных больных).
- Полирезистентность — устойчивость к двум и более препаратам.
- Множественная лекарственная устойчивость (МЛУ) — устойчивость к изониазиду и рифампицину одновременно (независимо от наличия устойчивости к другим препаратам). Она сопровождается, как правило, устойчивостью к стрептомицину и др. В настоящее время МЛУ возбудителей туберкулёза стала эпидемиологически опасным явлением. Расчёты показывают, что выявление возбудителей с МЛУ более чем в 6,6 % случаев (среди впервые выявленных больных) требует изменения стратегии Национальной противотуберкулёзной программы. В России, по данным мониторинга лекарственной устойчивости, частота МЛУ среди впервые выявленных больных составляет от 4 до 15 %, среди рецидивов — 45—55 %, а среди случаев неудачного лечения — до 80 %.
- Суперустойчивость — множественная лекарственная устойчивость в сочетании с устойчивостью к фторхинолонам и к одному из инъекционных препаратов (канамицин, амикацин, капреомицин). Туберкулёз, вызванный штаммами с суперустойчивостью, представляет прямую угрозу для жизни пациентов, так как остальные противотуберкулёзные препараты второго ряда не имеют выраженного эффекта. С 2006 года в некоторых странах организовано наблюдение за распространением штаммов микобактерий с суперустойчивостью. За рубежом принято обозначать этот вариант МЛУ как XDR (Extreme drug resistance).
- Перекрёстная устойчивость — когда возникновение устойчивости к одному препарату влечет за собой устойчивость к другим препаратам. У M. tuberculosis, как правило, ассоциированные с устойчивостью мутации не взаимосвязаны. Особенно часто перекрёстную устойчивость выявляют внутри одной группы препаратов, например аминогликозидов, что обусловлено одинаковой «мишенью» данной группы препаратов. Общемировой тенденцией является снижение эффективности антибактериальных препаратов.
источник
Несмотря на высокий уровень развития современной фармакологии и медицины, человечеству так и не удается победить туберкулез. Обычную форму заболевания научились успешно лечить, вплоть до полного выздоровления. Но из-за способности бактерии мутировать она часто становится нечувствительной к антибиотикам. Такая форма заболевания получила название «туберкулез МЛУ».
Туберкулез является инфекционным бактериальным заболеванием. В схему его лечения обязательно входит несколько антибиотиков. Если провести лечение до конца, возможно полное излечение от недуга.
Множественная лекарственная устойчивость туберкулеза – это приобретенная устойчивость микобактерий палочки Коха к противотуберкулезным препаратам первого ряда. Изониазид и Рифампицин считаются самыми эффективными медикаментами в борьбе с туберкулезом. Длительность лечения посредством этих препаратов составляет больше 6 месяцев.
Если пройти лечение до конца, не делая перерывы и не прекращая прием медикаментов, зачастую удается полностью устранить данный недуг, но в некоторых случаях, чаще при неправильной схеме терапии, бактерия становится нечувствительной к этим средствам.
В целом, симптомы заболевания не отличаются от обычного туберкулеза. Он может протекать как в закрытой, так и в открытой форме, возможно скрытое течение. Возможно образование каверн и инфильтрация бактерией всего органа. В редких случаях возможна внелегочная форма туберкулеза МЛО. Но лечение данного заболевания будет в разы дольше и тяжелее.
Несмотря на потерю чувствительности к двум антибиотиком, ТБ-МЛУ удается лечить рядом препаратов второго ряда. Они, несмотря на длительность лечения и множественные побочные действия, способны подавить и уничтожить патогенную флору.
Существует более тяжелая форма заболевания – туберкулез ШЛУ. Данное заболевание с широкой лекарственной устойчивостью вызывает огромные трудности в лечении. В данном случае спектр препаратов, к которому у палочки развилась устойчивость, значительно расширяется. Чаще всего предшественником этого заболевания является туберкулез МЛУ.
Одной из основных причин возникновения устойчивости к препаратам является недостаточно полное соблюдение врачебных рекомендаций, в частности, прекращение не доведенного до конца курса лечения. Часто это происходит из-за значительного улучшения состояния, и пациент принимает этот «период благополучия» за полное выздоровление.
На самом деле это не так. Не уничтоженная до конца бактерия, которая испытала влияние препарата, начинает претерпевать генные мутации, направленные на ее защиту от воздействия препарата. Это происходит не со всеми бактериями, но измененные бактерии в скором времени вытеснят неустойчивые микроорганизмы.
Через некоторое время заболевание вновь начнет себя проявлять, в некоторых случаях его течение будет скрытое. Но препараты, которые применялись в предыдущей схеме терапии, уже не будут работать.
ШЛУ – это следствие не до конца доведенного лечения множественного туберкулеза. В данном случае устойчивость инфекции наблюдается к препаратам, которые подобрали для терапии МЛУ. Таким образом, количество эффективных препаратов значительно уменьшается после каждого срыва лечения.
Также множественный туберкулез может стать причиной повторного заражения после выздоровления. Зачастую это возникает у людей из группы риска. С каждым новым заражением список устойчивых препаратов может увеличиваться. Возможно заражение уже устойчивой к лекарствам бактерией. Это происходит при контакте с больным открытой формой МЛУ или ШЛУ. Палочка Коха у таких пациентов передается людям уже с устойчивостью к лекарствам.
Исходя из вышеизложенных причин возникновения, можно выделить факторы, которые способствуют возникновению устойчивости к антибиотикам. Более подвержены развитию МЛУ такие люди:
нарушающие режим лечения пациенты, самостоятельно прекращающие прием антибиотиков;
- работники медицинских учреждений, особенно фтизиатрических больниц;
- жители районов с распространенным туберкулезом МЛУ;
- контактирующие с больными устойчивым туберкулезом людьми;
- повторно болеющие туберкулезом.
Часто устойчивость возникает из-за приема препаратов низкого качества (подделок). В данном случае поступление действующего вещества прекращается по независящим от пациента причинам. Подобные события являются севодня достаточно распространенными, несмотря на тщательный контроль фармакологических учреждений.
Иногда прием препаратов прекращается из-за отсутствия лекарства в регионе или в стране. Это происходит, когда препарат находится на перерегистрации или по каким-то другим причинам.
Огромную опасность несут люди, болеющие открытой формой устойчивого туберкулеза. Заражение от них происходит уже невосприимчивой к лечению инфекцией. Из-за этого рекомендуется лечить данных пациентов в изолированных палатах инфекционных больниц.
Это заболевание зачастую протекает как обычный туберкулез. Оно сопровождается потерей веса, повышением температуры, кашлем дольше 2 недель, кровохарканьем и другими симптомами. Отличием является невосприимчивость к стандартному лечению и дальнейшее прогрессирование заболевания. Зачастую, на фоне приема медикаментов пациент начинает себя чувствовать значительно лучше еще после первого месяца лечения. При МЛУ симптоматика будет только усиливаться, а состояние ухудшаться.
Часто наличие ТБ-МЛУ начинают подозревать после отсутствия положительного эффекта от применяемой терапии. Для выявления устойчивости можно использовать старые методы, которые подразумевают посев на питательные среды с различными антибиотиками.
В зависимости от антибиотика, на котором будет происходить рост бактерии, определяют антибиотик, к которому она не восприимчива. Данное исследование проводится несколько дней.
В настоящее время для постановки диагноза используют специальные тесты, быстро определяющие чувствительность бактерии. Они могут быть молекулярными и культуральными. Наиболее быстрый результат дают молекулярные тесты – от 2 часов до 1-2 дней. Несмотря на высокую эффективность, они не требуют больших финансовых вложений, что дает возможность использовать их даже в бедных регионах.
В случае первичного инфицирования, вначале применяют стандартные способы диагностики:
- проба Манту;
- флюорография;
- рентгенография;
- КТ;
- микроскопическое исследование мокроты.
При обнаружении туберкулеза используют вышеописанные методы для мониторинга эффективности терапии.
Если у пациента обнаруживается устойчивый туберкулез легких, то лечение его становится крайне затруднительным. Обязательной является психологическая работа с пациентом, так как длительная терапия негативно сказывается на психическом здоровье больного.
Из-за невозможности применять менее опасные препараты первого выбора, необходимо принимать препараты второй линии, более опасные для всего организма:
- Хинолины.
- Циклосерин.
- Линезолид.
- Протионамид/Этионамид.
Многие врачи сравнивают терапию данными препаратами с химиотерапией, применяемой в терапии онкологических болезней. Препараты вызывают сильнейшие желудочные расстройства, боли в животе, тошноту, сильные мышечные и суставные боли.
Из-за токсичности страдают печень, почки, сердце и другие органы. Необходимо обязательно применять препараты, защищающие их. В некоторых случаях возможны нарушения со стороны психики пациента, вплоть до попыток суицида. Несмотря на это следует придерживаться назначенной схемы лечения, так как это единственный вариант лечения ТБ-МЛУ.
Из-за отсутствия безопасного лечения возможно возникновение полиорганной недостаточности, как на фоне заболевания, так и из-за токсичности заболевания. Болезнь может привести к развитию туберкулезного менингита, возможно распространение инфекции по всему организму.
Заболевание крайне опасно для общества. Инфекция, характеризующаяся устойчивостью, тяжело поддается терапии.
Наибольшую опасность представляет бактерия, выработавшая устойчивость к препаратам второго ряда. Данные препараты являются последними работающими медикаментами. Фармакология, не смотря на постоянные разработки, еще не разработала препараты, которые сумели бы быстро и эффективно лечить данное заболевание.
Несмотря на проводимое лечение, возникает множество трудностей с устранением данной инфекции. Многие пациенты из-за тяжелых побочных эффектов не выдерживают лечение. Из-за длительного течения болезни, в организме возникает множество функциональных и морфологических изменений, которые в дальнейшем невозможно восстановить.
В случае излечения человека от инфекции, зачастую он остается инвалидом. Также возможно повторное инфицирование. Часто заболевание заканчивается летальным исходом.
Для предотвращения перехода обычного туберкулеза в устойчивый необходимо четко и добросовестно придерживаться лечебной схемы. Значительное улучшение состояния в первые месяцы терапии не является признаком уничтожения инфекции и требует продолжения приема препаратов.
Для снижения количества передачи инфекции от ее источников рекомендуется изолировать пациентов с открытой формой МЛУ и ШЛУ. Но данные меры не всегда удается применять, многие пациенты, чаще из асоциальных слоев населения, отказываются от госпитализации и терапии.
Следует стараться избегать повторного инфицирования. Если есть факторы, способствующие заражению – необходимо их устранять. Обязательными являются своевременные диагностические мероприятия, направленные на раннее выявление заболевания. Важную роль играет общественная пропаганда диагностики заболевания.
Данное заболевание является следствием безответственности, в первую очередь пациентов. Ученые совершили огромный прорыв в терапии туберкулезной инфекции. Если раньше от нее в 100% случаев умирали – сейчас удается полностью излечить больных людей.
Но если в дальнейшем количество прерываемых курсов лечения не снизится – существует огромный риск прогрессирования МЛУ и ШЛУ в обществе, вплоть до развития устойчивости бактерии ко всем существующим препаратам. В таком случае излечение данной патологии будет невозможным.
источник
Лекарственная устойчивость — закономерное и одно из самых значимых проявлений изменчивости МБТ, отражающей основной биологический закон, выражение приспособления биологических видов к окружающей среде.
По последним научным данным, основные механизмы развития лекарственной устойчивости МБТ к противотуберкулезным препаратам — мутации в гене, ответственном за обменные процессы, и синтез белка-фермента, инактивирующего конкретный препарат.
Изучение биологических особенностей, ферментативной активности, химического состава лекарственно-устойчивых МБТ в сравнении с лекарственно-чувствительными, генетически однородными МБТ позволило выделить несколько основных механизмов, обусловливающих резистентность бактериальной клетки к данному антибактериальному агенту:
• появление нового пути обменных процессов, обходящего те обменные процессы, на которые воздействует данный препарат;
• увеличение синтеза фермента, который инактивирует данный препарат;
• синтез измененного фермента, который слабее инактивируется данным препаратом;
• уменьшение проницаемости бактериальной клетки в отношении данного препарата.
Все эти процессы могут происходить внутри бактериальной клетки и на уровне клеточной мембраны МБТ.
К настоящему времени установлены характерные особенности МБТ, устойчивых к различным противотуберкулезным препаратам, и изучены практически все гены, контролирующие лекарственную устойчивость к этим препаратам.
В большой и активно размножающейся микобактериальной популяции всегда имеется небольшое количество лекарственно-устойчивых спонтанных мутантов.
С учетом того что в каверне величина микобактериальной популяции составляет 10 -8… -11 там имеются мутанты ко всем противотуберкулезным препаратам. Поскольку большинство мутаций специфичны для отдельных препаратов, спонтанные мутанты, как правило, устойчивы только к одному препарату. Это явление называют эндогенной (спонтанной) лекарственной устойчивостью МБТ.
При правильном проведении химиотерапии эти мутанты практического значения не имеют, однако в результате неправильного лечения, когда больным назначают неадекватные режимы и сочетания противотуберкулезных препаратов и не дают оптимальные дозы при расчете в мг/кг массы тела больного, изменяется соотношение между количеством лекарственно-устойчивых и чувствительных МБТ. Происходит естественный отбор лекарственно-устойчивых мутантов к противотуберкулезным препаратам при неадекватной химиотерапии, что при длительном воздействии может вести к изменению генома микобактериальной клетки без обратимости чувствительности. В этих условиях происходит размножение главным образом лекарственно-устойчивых МБТ, эта часть бактериальной популяции увеличивается. Это явление
определяется как экзогенная (индуцированная) лекарственная устойчивость.
Наряду с этим выделяют первичную лекарственную устойчивость —
устойчивость МБТ, определяемую у больных туберкулезом, не принимавших противотуберкулезные препараты. В данном случае больной заразился МБТ с устойчивостью к противотуберкулезным препаратам.
Первичная лекарственная устойчивость МБТ у больного туберкулезом характеризуется состоянием микобактериальной популяции, циркулирующей в данном регионе или стране, и ее показатели важны для оценки степени напряженности эпидемической ситуации и выработки региональных режимов химиотерапии.
Вторичная (приобретенная) лекарственная устойчивость определяется как устойчивость МБТ, развивающаяся в процессе химиотерапии у конкретного больного туберкулезом. Приобретенную лекарственную устойчивость следует рассматривать у тех больных, которые имели в начале лечения чувствительные МБТ, с развитием устойчивости через 3—6 мес.
Вторичная лекарственная устойчивость МБТ — объективный клинический критерий неэффективно проводимой химиотерапии. В клинической практике необходимо исследовать лекарственную чувствительность МБТ и по результатам этих данных подбирать соответствующий индивидуальный режим химиотерапии, а его эффективность сопоставлять с динамикой туберкулезного процесса.
По эпидемиологической классификации ВОЗ (2008) МБТ могут быть:
• монорезистентными (МР) — к одному противотуберкулезному препарату;
• полирезистентными (ПР) — к двум и более противотуберкулезным препаратам, но не к сочетанию изониазида и рифампицина;
• множественно лекарственно-резистентными (МЛУ) — как минимум к сочетанию изониазида и рифампицина;
• широко лекарственно-резистентными (ШЛУ) — как минимум к сочетанию изониазида, рифампицина, фторхинолонов и инъекционных препаратов (канамицина, амикацина и капреомицина).
Данная классификация дает представление о частоте распространенности региональной первичной и вторичной лекарственной устойчивости МБТ к трем самым эффективным противотуберкулезным препаратам — изониазиду, рифампицину и фторхинолонам, особенно при их сочетании. Это обусловлено тем, что частота распространенности МЛУ и ШЛУ в каждой стране различна.
Туберкулез легких — инфекционное заболевание, при котором развитие эпидемиологического процесса и химиотерапия больных зависят от частоты и характера лекарственной устойчивости МБТ, циркулирующих в данном регионе, что обусловливает региональный подбор наиболее эффективной комбинации противотуберкулезных препаратов.
Региональный подбор комбинации противотуберкулезных препаратов для химиотерапии больных туберкулезом должен соответствовать уровню распространенности МЛУ МБТ в конкретном регионе и стране.
В клинических условиях для эффективного проведения химиотерапии у конкретного больного необходимо знать индивидуальный спектр лекарственной чувствительности МБТ.
По клинической классификации В.Ю. Мишина (2002) больных, выделяющих МБТ, разделяют на три группы:
•больные с МБТ, чувствительными ко всем противотуберкулезным препаратам;
•больные с ПР и МЛУ МБТ к основным противотуберкулезным препаратам;
•больные с ПР и МЛУ МБТ к сочетанию основных и резервных противотуберкулезных препаратов.
Эта классификация определяет индивидуальную устойчивость МБТ. Такое деление лекарственной устойчивости имеет клиническое значение в плане адекватности режимов химиотерапии, что позволяет персонально подбирать дозу и комбинации основных и резервных противотуберкулезных препаратов у конкретного больного.
источник
Какие возможны варианты туберкулеза легких по отношению к лекарственному лечению? Какова роль фторхинолонов в лечении туберкулеза легких?
Какие возможны варианты туберкулеза легких по отношению к лекарственному лечению?
Какова роль фторхинолонов в лечении туберкулеза легких?
Первый вариант мы определяем как лекарственно- чувствительный туберкулез легких (ЛЧТЛ), вызванный микобактериями туберкулеза (МБТ), чувствительными ко всем противотуберкулезным препаратам (ПТП). ЛЧТЛ встречается в основном у впервые выявленных и реже у рецидивных больных. На чувствительные МБТ бактерицидно действуют основные ПТП: изониазид, рифампицин, пиразинамид, стрептомицин и/или этамбутол. Поэтому в настоящее время для наиболее эффективного лечения лекарственно-устойчивого туберкулеза легких (ЛУТЛ) с учетом влияния химиопрепаратов на микобактериальную популяцию, чувствительную к ПТП, Международный союз по борьбе с туберкулезом и другими заболеваниями легких (МСБТЛЗ) и ВОЗ предлагают двухэтапные укороченные курсы комбинированной химиотерапии под непосредственным медицинским наблюдением [1].
Первый этап характеризуется проведением интенсивной насыщенной химиотерапии четырьмя-пятью ПТП в течение 2-3 месяцев, что ведет к подавлению размножающейся микобактериальной популяции, уменьшению ее количества и предотвращению развития лекарственной резистентности. На первом этапе используется комбинация препаратов, состоящая из изониазида, рифампицина, пиразинамида, стрептомицина и/или этамбутола.
Второй этап — менее интенсивной химиотерапии — проводится, как правило, двумя-тремя ПТП. Цель второго этапа — воздействие на оставшуюся бактериальную популяцию, в большинстве своем находящуюся внутриклеточно в виде персистирующих форм микобактерий. Здесь главной задачей является предупреждение размножения оставшихся микобактерий, а также стимуляция репаративных процессов в легких с помощью различных патогенетических средств и методов лечения.
Такой методический подход к лечению ЛЧТЛ позволяет к концу первого этапа комбинированной химиотерапии под непосредственным медицинским наблюдением абациллировать 100%, а к завершению всего курса лечения — закрыть каверны в легких у более чем 80% больных с впервые выявленным и рецидивным туберкулезом легких [5].
Намного сложнее вопрос о проведении этиотропного лечения второго варианта, к которому мы относим ЛУТЛ, вызванный лекарственно резистентными (ЛР) МБТ к одному и более ПТП и/или их сочетанию. Особенно тяжело протекает ЛУТЛ у больных с множественной ЛР МБТ к изониазиду и рифампицину, то есть к основным и самым эффективным ПТП. Поэтому поиск новых концептуальных путей повышения эффективности лечения ЛУТЛ и разработка современной методологии специфического воздействия на ЛР МБТ является одним из важнейших и приоритетных направлений современной фтизиатрии.
 |
Развитие ЛР у МБТ к ПТП — одна из главных причин недостаточно эффективной этиотропной химиотерапии. Больные туберкулезом, выделяющие ЛР-штаммы МБТ, длительное время остаются бактериовыделителями и могут заражать окружающих ЛР-возбудителем. Чем больше число больных, выделяющих ЛР МБТ, тем выше риск распространения инфекции среди здоровых лиц и появления новых случаев заболевания туберкулезом с первичной резистентностью не только к основным, но и к резервным ПТП.
Феномен ЛР МБТ имеет важное клиническое значение. Существует тесная взаимосвязь количественных изменений микобактериальной популяции и изменения ряда биологических свойств МБТ, одним из которых является ЛР. В активно размножающейся бактериальной популяции всегда имеется небольшое количество ЛР-мутантов, которые практического значения не имеют, но по мере уменьшения бактериальной популяции под влиянием химиотерапии изменяется соотношение между количеством ЛР и устойчивых МБТ [5]. В этих условиях происходит размножение главным образом устойчивых МБТ, эта часть бактериальной популяции увеличивается. Следовательно, в клинической практике необходимо исследовать ЛР МБТ и результаты этого исследования сопоставлять с динамикой туберкулезного процесса в легких [5].
По определению экспертов ВОЗ [3], ЛУТЛ — это случай туберкулеза легких с выделением МБТ, резистентных к одному и более ПТП. По данным Центрального НИИ туберкулеза РАМН, у каждого второго впервые выявленного и ранее не леченного противотуберкулезными препаратами больного в мокроте выявлялись ЛР к ПТП МБТ, при этом у 27,7% из них наблюдалась устойчивость к двум основным противотуберкулезным препаратам — изониазиду и рифампицину. При хроническом фиброзно-кавернозном туберкулезе частота вторичной ЛР МБТ возрастает до 95,5%.
По нашему мнению, и это составляет основу нашей концепции, для повышения эффективности лечения туберкулеза, вызванного ЛР МБТ, необходимо в первую очередь использовать ускоренные методы выявления ЛР МБТ, что позволяет своевременно изменять режим химиотерапии.
Исследование лекарственной устойчивости МБТ в настоящее время возможно по прямому и непрямому методам.
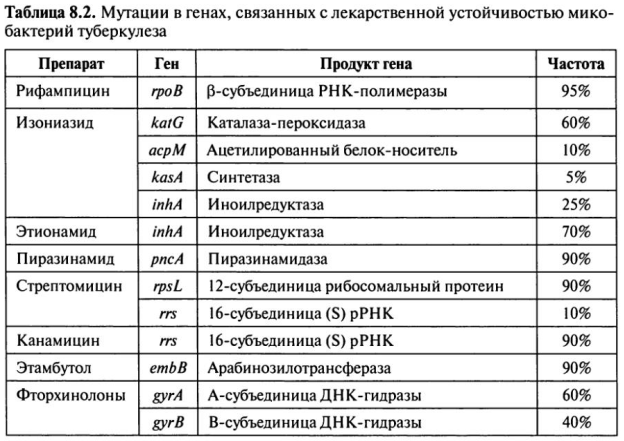
Прямой метод определения ЛР МБТ осуществляется путем непосредственного посева мокроты на твердые питательные среды с добавлением определенных концентраций ПТП (см. табл.). Результаты прямого микробиологического метода определения лекарственной устойчивости МБТ учитываются на 21 — 28-й день, что позволяет в этот срок провести коррекцию химиотерапии.
Непрямой метод определения лекарственной чувствительности МБТ требует от 30 до 60, а иногда до 90 суток, ввиду того что вначале производится посев мокроты на твердые питательные среды и только после получения культуры МБТ производят ее пересев уже на среды с добавлением ПТП. При этом коррекция химиотерапии носит отсроченный характер, как правило, уже на конечном этапе интенсивной фазы химиотерапии.
В последнее время для ускоренного определения лекарственной устойчивости нами применялся радиометрический метод с использованием автоматической системы ВАСТЕС-460 ТВ (Becton Dickinson Diagnostic Systems, Sparks, MD), которая позволяет выявлять лекарственную резистентность МБТ на жидкой среде Middlebrook 7H10 через 6-8 дней.
Не менее важно правильное лечение впервые выявленных больных туберкулезом легких и применение современных режимов химиотерапии с использованием в начале лечения комбинации из четырех-пяти основных противотуберкулезных препаратов до получения результатов лекарственной устойчивости МБТ [2]. В этих случаях существенно повышается вероятность того, что даже при наличии первичной ЛР МБТ бактериостатическое действие окажут два или три химиопрепарата, к которым чувствительность сохранена. Именно несоблюдение фтизиатрами научно обоснованных комбинированных режимов химиотерапии при лечении впервые выявленных и рецидивных больных и назначение ими только трех ПТП является грубой врачебной ошибкой, что в конечном счете ведет к формированию наиболее трудно поддающейся лечению вторичной ЛР МБТ.
Наличие у больного туберкулезом легких ЛР МБТ существенно снижает эффективность лечения, приводит к появлению хронических и неизлечимых форм, а в ряде случаев и летальных исходов. Особенно тяжело протекают специфические поражения легких у больных с полирезистентными МБТ, которые обладают множественной ЛР, как минимум к изониазиду и рифампицину, т. е. к основным и самым активным противотуберкулезным препаратам. ЛР МБТ имеет не только чисто клиническое и эпидемиологическое, но и экономическое значение, так как лечение таких больных резервными ПТП обходится намного дороже, чем больных с чувствительными МБТ к основным химиопрепаратам.
В этих условиях расширение списка резервных ПТП, воздействующих на ЛР МБТ, является актуальным и крайне важным для повышения эффективности лечения больных с ЛУТЛ. Кроме того, присоединение к ЛУТЛ неспецифической бронхолегочной инфекции существенным образом утяжеляет течение специфического процесса в легких, требуя назначения дополнительных антибиотиков широкого спектра. В этом плане применение антибиотиков, воздействующих как на МБТ, так и на неспецифическую патогенную бронхолегочную микрофлору, является научнообоснованным и целесообразным.
В этом плане хорошо себя зарекомендовал в России такой препарат из группы фторхинолонов, как офлоксацин (таривид) [3]. Мы же свой выбор остановили на ломефлоксацине, как препарате, который еще не столь широко применяется при лечении туберкулеза и у которого, судя по имеющимся данным, практически не выявляются побочные эффекты и крайне редко формируется ЛР возбудителей инфекционных заболеваний [2].
Ломефлоксацин (максаквин) — антибактериальный препарат из группы фторхинолонов. Как и все представители производных оксихинолонкарбоновой кислоты, максаквин обладает высокой активностью против грамположительных (включая метициллин-устойчивые штаммы Staphylococcus aureus и Staphylococcus epidermidis) и грамотрицательных (включая Pseudomonas) микроорганизмов, в том числе по отношению к различным типам Micobacterium tuberculosis).
Механизм действия максаквина заключается в ингибировании хромосомной и плазмидной ДНК-гиразы, фермента, ответственного за стабильность пространственной структуры микробной ДНК. Вызывая деспирилизацию ДНК микробной клетки, максаквин ведет к гибели последней.
Максаквин обладает иным механизмом действия, нежели другие антибактериальные средства, поэтому к нему не существует перекрестной устойчивости с другими антибиотиками и химиотерапевтическими препаратами [2].
Основной целью настоящего исследования явилось изучение клинической и микробиологической эффективности максаквина при комплексном лечении больных деструктивным ЛУТЛ, выделяющих ЛР МБТ к изониазиду, рифампицину и другим ПТП, а также при сочетании туберкулеза с неспецифической бронхолегочной инфекцией.
Под наблюдением находилось 50 больных деструктивным ЛУТЛ, выделяющих с мокротой ЛР МБТ к изониазиду, рифампицину и ряду других ПТП. Эти люди в возрасте от 20 до 60 лет составили основную группу.
В контрольную группу вошли также 50 больных деструктивным ЛУТЛ легких в той же возрастной группе, выделяющие ЛР МБТ к изониазиду, рифампицину и другим ПТП. Эти пациенты лечились только протионамидом, амикацином, пиразинамидом и этамбутолом.
У 47 больных основной группы и 49 контрольной в мокроте микробиологическими методами были выявлены различные возбудители неспецифической бронхолегочной инфекции.
Среди больных основной группы диссеминированный туберкулез был установлен у 5 человек, инфильтративный — у 12, казеозная пневмония — у 7, кавернозный — у 7 и фиброзно-кавернозный туберкулез — у 17 человек. Большинство больных (45 пациентов) имели распространенный туберкулез легких с поражением более двух долей, у 34 больных был двусторонний процесс. У всех больных основной группы в мокроте были обнаружены МБТ, как методом микроскопии по Цилю — Нильсену, так и методом посева на питательные среды. При этом у них МБТ были устойчивы как минимум к изониазиду и рифампицину. Необходимо отметить, что все пациенты уже ранее неоднократно и неэффективно лечились основными ПТП, и специфический процесс у них приобрел рецидивирующий и хронический характер.
В клинической картине преобладали симптомы интоксикации с высокой температурой тела, потливостью, адинамией, изменениями в крови воспалительного характера, лимфопенией, увеличенной СОЭ до 40-50 мм в час. Следует отметить наличие грудных проявлений болезни — кашель с выделением мокроты, подчас значительного количества, слизисто-гнойной, а у половины больных — гнойной, с неприятным запахом. В легких выслушивались обильные катаральные явления по типу мелко-, средне-, а подчас и крупнопузырчатых влажных хрипов.
У большинства больных преобладали клинические проявления, которые скорее укладывались в картину неспецифического бронхолегочного поражения (бронхита, острой пневмонии, абсцедирования) с частыми и практически не стихающими обострениями.
Основным возбудителем неспецифической инфекции был Streptococcus hemoliticus — у 15,3% и Staphilococcus aureus — у 15% больных. Среди грамотрицательной микрофлоры преобладал Enterobacter cloacae в 7,6% случаев. Следует отметить высокую частоту ассоциации возбудителей неспецифической бронхолегочной инфекции.
МБТ были обнаружены у всех 50 больных. У 42 человек определялось обильное бактериовыделение. У всех пациентов выделенные штаммы МБТ были устойчивы к изониазиду и рифампицину. При этом у 31 больного лекарственная устойчивость МБТ к изониазиду и рифампицину сочеталась с другими ПТП.
Определение минимальной ингибирующей концентрации (МИК) максаквина проводили на лабораторных штаммах H37Rv и Academia, а также клинических штаммах (изолятах), выделенных от 30 больных, из которых 12 изолятов были чувствительны ко всем основным химиопрепаратам и 8 обладали резистентностью к изониазиду, рифампицину и стрептомицину. В опытах in vitro подавление роста лабораторных штаммов МБТ наблюдалось в зоне 57,6±0,04 до 61,8±0,02 мкн/мл, что почти в семь раз больше, чем показатели, характерные для остальных ПТП .
Таким образом, в ходе микробиологических исследований было установлено выраженное бактериологическое действие максаквина на МБТ, при этом более выраженный эффект наблюдался при его воздействии на лекарственно чувствительные штаммы и изоляты. Однако при повышенных концентрациях максаквина эффект также заметен при воздействии на полирезистентные МБТ, устойчивые к основным ППТ.
Лечение максаквином проводилось у всех 50 больных основной группы в разработанной нами комбинации с другими резервными препаратами: протионамидом, амикацином, пиразинамидом и этамбутолом.
Максаквин назначали в дозе 800 мг в сутки перорально однократно в утренние часы сразу вместе с другими противотуберкулезными препаратами для создания максимальной суммарной бактериостатической концентрации в крови и очагах поражения. Доза максаквина выбрана с учетом микробиологических исследований и соответствовала МИК, при которой отмечалось существенное подавление роста МБТ. Терапевтический эффект определяли через месяц — для оценки воздействия его на неспецифическую патогенную бронхолегочную микрофлору и через два месяца — для оценки воздействия на полирезистентные МБТ. Длительность курса лечения резервными химиопрепаратами в сочетании с максаквином составляла два месяца.
Через месяц комплексного лечения было отмечено значительное улучшение состояния больных основной группы, что проявлялось в уменьшении количества мокроты, кашля и катаральных явлений в легких, снижении температуры тела, при этом более чем у двух третей больных — до нормальных цифр.
У всех больных к этому сроку в мокроте перестал определяться рост вторичной патогенной бронхолегочной микрофлоры. К тому же у 34 больных значительно уменьшилась массивность выделения микобактерий туберкулеза. Практически у всех больных нормализовались анализы крови.
Следует отметить, что у 28 пациентов рентгенологически через месяц лечения максаквином в сочетании с протионамидом, амикацином, пиразинамидом и этамбутолом отмечалось частичное рассасывание специфических инфильтративных изменений в легких, а также существенное уменьшение перикавитарной воспалительной реакции. Это позволило применить на данном этапе искусственный пневмоторакс, который является обязательным методом в лечении ЛУТЛ и составляет вторую и не менее важную часть нашей концепции повышения эффективности лечения больных деструктивным туберкулезом легких, выделяющих полилекарственнорезистентные МБТ.
При анализе эффективности специфического действия комбинации резервных противотуберкулезных препаратов в сочетании с максаквином на полирезистентные МБТ при лечении 50 больных основной группы мы делали основной акцент на показатель прекращения бактериовыделения, как по микроскопии мокроты по Цилю — Нильсену, так и по посеву на питательные среды через два месяца после химиотерапии.
Анализ частоты прекращения бактериовыделения у больных основной и контрольной группы через два месяца лечения показал, что у пациентов, получавших максаквин в сочетании с протионамидом, амикацином, пиразинамидом и этамбутолом, прекращение бактериовыделения было достигнуто в 56% случаях. В контрольной группе больных, не получавших максаквина, — только в 30% случаев.
Следует отметить, что у остальных больных основной группы за этот период времени существенно уменьшилась массивность выделения МБТ.
Инволюция локальных изменений в легких у 50 больных контрольной группы также шла более замедленными темпами, и только у 25 больных к концу второго месяца удалось достичь частичного рассасывания перикавитарной инфильтрации и применить к ним искусственный пневмоторакс. К 39 из 50 пациентов основной группы был применен искусственный пневмоторакс в течение 1,5-2 месяцев, и 17 из них удалось достигнуть закрытия каверн в легких. 11 оставшихся больных, имеющих противопоказания к проведению искусственного пневмоторакса, в этот период были подготовлены к плановому оперативному вмешательству.
При определении лекарственной устойчивости МБТ к максаквину через два месяца лечения у больных основной группы только в 4% случаев была получена вторичная лекарственная устойчивость, сформировавшаяся в процессе двухмесячной химиотерапии, что в конечном итоге потребовало его отмены и замены на другой химиопрепарат, к которому МБТ сохранили свою чувствительность.
Переносимость препарата была хорошей. Только у одного больного через месяц применения было выявлено транзиторное повышение «печеночных» трансаминаз при отсутствии клинических проявлений поражений печени. Печеночные тесты нормализовались без отмены препарата при назначении гепатопротекторов.
К концу второго месяца у 4% больных отмечались явления непереносимости максаквина — в виде диспепсических явлений и диареи, связанной с дисбактериозом, аллергических кожных проявлений и эозинофилии до 32%, что привело к полной отмене препарата. Во всех остальных случаях при двухмесячном ежедневном применении максаквина в суточной дозе 800 мг побочных явлений не отмечалось.
Проведенная после окончания курса лечения максаквином комбинированная химиотерапия резервными препаратами и динамическое наблюдение за этими же больными показали, что достигнутый ко второму месяцу положительный результат в абациллировании мокроты оказал положительное влияние и на конечный результат излечения больных с ЛУТЛ.
Таким образом, применение максаквина в дозе 800 мг в сутки в сочетании с протионамидом, амикацином, пиразинамидом и этамбутолом у больных деструктивным ЛУТЛ с сопутствующей неспецифической бронхолегочной инфекцией показало его достаточную эффективность как антибиотика широкого спектра, воздействующего на грамотрицательную и грамположительную микрофлору, и препарата, действующего на туберкулезное воспаление.
Максаквин с полной уверенностью может быть отнесен к группе резервных ПТП. Он эффективно действует не только на МБТ, чувствительные ко всем ПТП, но и на ЛУ МБТ к изониазиду и рифампицину, что и обусловливает целесообразность его назначения таким больным. Тем не менее максаквин не следует рассматривать как основной препарат в схемах лечения больных с впервые выявленным туберкулезом легких, он должен оставаться в резерве и применяться только при ЛУТЛ и сопутствующей неспецифической бронхолегочной инфекции.
Для изониазида это составляет 1 мкг/мл, для рифампицина — 40 мкг/мл, стрептомицина — 10 мкг/мл, этамбутола — 2 мкг/мл, канамицина — 30 мкг/мл, амикацина — 8 мкг/мл, протионамида (этионамида) — 30 мкг/мл, офлоксацина (таривида) — 5 мкг/мл, циклосерина — 30 мкг/мл и для пиразинамида — 100 мкг/мл.
1. Лечение туберкулеза. Рекомендации для национальных программ. ВОЗ. 1998. 77 с.
2. Мишин. В. Ю., Степанян И. Э. Фторхинолоны в лечении туберкулеза органов дыхания // Русский медицинский журнал. 1999. № 5. С. 234-236.
3. Рекомендации по лечению резистентных форм туберкулеза. ВОЗ. 1998. 47 с.
4. Хоменко А. Г., Мишин В. Ю., Чуканов В. И. и др. Эффективность применения офлоксацина в комплексном лечении больных туберкулезом легких, осложненным неспецифической бронхолегочной инфекцией // Новые лекарственные препараты. 1995. Вып. 11. С. 13-20.
5. Хоменко А. Г. Современная химиотерапия туберкулеза // Клиническая фармакология и терапия. 1998. № 4. С. 16-20.
источник
 нарушающие режим лечения пациенты, самостоятельно прекращающие прием антибиотиков;
нарушающие режим лечения пациенты, самостоятельно прекращающие прием антибиотиков;