Одним из характерных свойств МБТ является их способность изменяться под воздействием внешних факторов. Полиморфизм возбудителя проявляется в образовании нитевидных цетных, кокковидных и лекарственно-устойчивых форм. Другой формой клеточного полиморфизма является образование, обусловленное утратой плотной клеточной стенки и образованием сферопластов, окруженных цитоплазматической мембраной, сходной с мембраной клеток макроорганизма. В связи с такой перестройкой меняется не только морфология МБТ, но и антигенный состав, и степень патогенности для человека и животных. L-формы МБТ устойчивы к большинству противотуберкулезных препаратов и характеризуются резко сниженным уровнем метаболизма и ослабленной вирулентностью. L-формы могут длительное время персистировать в организме и поддерживать противотуберкулезный иммунитет. При снижении иммунореактивности организма они способны активизироваться, превращаться в типичные микобактерии, вызывая реактивацию специфического процесса. Выявлен ген, участвующий в превращении типичных МБТ в L-формы. МБТ могут также существовать в виде ультрамелких фильтрующихся форм, представляющих собой частицы (0,22—0,24 мкм) округлой формы, некоторые из них окружены плотной клеточной стенкой. Таким образом, при неблагоприятном изменении каких-либо параметров среды обитания МБТ утрачивают клеточную стенку и трансформируются в обладающие повышенной устойчивостью к вредным воздействиям — гипоксии, действию противотуберкулезных препаратов и др. Они приобретают способность долго сохраняться и даже размножаться почкованием в виде зернистых различной величины шаров. При длительном неблагоприятном воздействии (например, продолжительный курс химиотерапии) зернистые шары могут распадаться на мельчайшие некислотоустойчивые фильтрующиеся формы. При исключении неблагоприятных факторов фильтрующиеся и формы реверсируются в классическую палочковидную форму.
Заражение туберкулезом чаще всего возникает через дыхательные пути (аспирационный путь) при контакте с заразным больным, который выделяет во внешнюю среду содержащиеся в капельных ядрышках и пылевых частицах. Только менее 10% этих частиц размером не больше 5 мкм попадают в альвеолы и вызывают заражение. Подавляющее большинство остальных, более крупных, частиц оседает на слизистой оболочке верхних дыхательных путей и удаляются оттуда благодаря функции мукоциллиарного клиренса. При энтеральном заражении определенное значение имеет всасывающая функция кишечника.
Для инфицирования и развития заболевания туберкулезом основное значение имеют, во-первых, массивность инфекции, доза и длительность поступления МБТ в организм человека, во-вторых, состояние неспецифических и специфических факторов защиты в период воздействия инфекционного агента.
Механизмы защиты бронхолегочной системы действуют на уровне проводящих и респираторных отделов и осуществляются за счет конденсирования воздуха, механической очистки, эндоцитоза бронхиальным эндотелием, путем клеточной неспецифической защиты.
Неповрежденная слизистая оболочка полости рта, носоглотки и верхних дыхательных путей является непроницаемым барьером для МБТ. Здесь осуществляются механическая очистка воздуха за счет фильтрации и осаждения инородных частиц, удаление их вследствие чихания и кашля. Наиболее значимой частью механической очистки является мукоцилиарный клиренс на уровне бронхов и бронхиол. Клиренс обеспечивается секретом, содержащий лизоцим, протеазы, сурфактант, иммуноглобулин A (IgA), которые опсонируют МБТ, и движением ресничек бронхиального эпителия выводят их из организма.
Нарушение целости слизистой оболочки полости рта и носоглотки, кариозные зубы, автозный стоматит, парадонтоз, синусит, хронический тонзиллит, а также периоды возрастной смены зубов у детей могут являться входными воротами для туберкулезной инфекции.
В трахее и крупных бронхах МБТ, как правило, не задерживаются и оседают в нижних дыхательных путях и альвеолах. Некоторая часть микобактерий остается на месте проникновения, другая с током лимфы и крови переносится к месту внедрения — в региональные лимфатические узлы. В зависимости от локализации входных ворот инфекции могут поражаться подчелюстные, шейные, над- и подключичные, подмышечные внутригрудные и другие региональные лимфатические узлы. В лимфатических узлах МБТ взаимодействуют с клетками иммунной системы, вызывая целый каскад реакций, ведущих к иммунологической перестройке организма к туберкулезной инфекции и формированию специфического клеточного иммунитета.
Локальные изменения в месте внедрения МБТ обусловлены прежде всего неспецифической реакцией полинуклеарных клеток (нейтрофилы), которые фагоцитируют возбудитель. Фагоцитоз является единственным естественным механизмом уничтожения МБТ в организме человека.
Под влиянием токсинов МБТ нейтрофилы разрушаются, вызывая воспалительную реакцию, которая сменяется более совершенной защитной реакцией с участием макрофагов, осуществляющих фагоцитоз и разрушение возбудителя. От активности фагоцитоза во многом зависит эффективность всей системы противотуберкулезной защиты организма. Макрофаги в очаге воспаления принимают форму эпителиоидных клеток, которые сливаются вместе, образуют гигантские клетки, однако при туберкулезе самостоятельно макрофаги уничтожить МБТ не могут. Необходимо активирующее воздействие на них сенсибилизированных клеток, в частности субпопуляции Т-хелперов (CD4+ клетки) и Т-супрессоров (CD8+ клетки).
Важный антимикробный механизм активированных макрофагов, направленный против внутриклеточных возбудителей, связан с цитотоксическим действием L-аргинина. Цитотоксический эффект этого механизма опосредован оксидом азота (NO).
источник
Одним из характерных свойств МБТ является их способность изменяться под воздействием внешних факторов. Полиморфизм возбудителя проявляется в образовании нитевидных цетных, кокковидных и лекарственно-устойчивых форм. Другой формой клеточного полиморфизма является образование, обусловленное утратой плотной клеточной стенки и образованием сферопластов, окруженных цитоплазматической мембраной, сходной с мембраной клеток макроорганизма. В связи с такой перестройкой меняется не только морфология МБТ, но и антигенный состав, и степень патогенности для человека и животных. L-формы МБТ устойчивы к большинству противотуберкулезных препаратов и характеризуются резко сниженным уровнем метаболизма и ослабленной вирулентностью. L-формы могут длительное время персистировать в организме и поддерживать противотуберкулезный иммунитет. При снижении иммунореактивности организма они способны активизироваться, превращаться в типичные микобактерии, вызывая реактивацию специфического процесса. Выявлен ген, участвующий в превращении типичных МБТ в L-формы. МБТ могут также существовать в виде ультрамелких фильтрующихся форм, представляющих собой частицы (0,22—0,24 мкм) округлой формы, некоторые из них окружены плотной клеточной стенкой. Таким образом, при неблагоприятном изменении каких-либо параметров среды обитания МБТ утрачивают клеточную стенку и трансформируются в обладающие повышенной устойчивостью к вредным воздействиям — гипоксии, действию противотуберкулезных препаратов и др. Они приобретают способность долго сохраняться и даже размножаться почкованием в виде зернистых различной величины шаров. При длительном неблагоприятном воздействии (например, продолжительный курс химиотерапии) зернистые шары могут распадаться на мельчайшие некислотоустойчивые фильтрующиеся формы. При исключении неблагоприятных факторов фильтрующиеся и формы реверсируются в классическую палочковидную форму.
Заражение туберкулезом чаще всего возникает через дыхательные пути (аспирационный путь) при контакте с заразным больным, который выделяет во внешнюю среду содержащиеся в капельных ядрышках и пылевых частицах. Только менее 10% этих частиц размером не больше 5 мкм попадают в альвеолы и вызывают заражение. Подавляющее большинство остальных, более крупных, частиц оседает на слизистой оболочке верхних дыхательных путей и удаляются оттуда благодаря функции мукоциллиарного клиренса. При энтеральном заражении определенное значение имеет всасывающая функция кишечника.
Для инфицирования и развития заболевания туберкулезом основное значение имеют, во-первых, массивность инфекции, доза и длительность поступления МБТ в организм человека, во-вторых, состояние неспецифических и специфических факторов защиты в период воздействия инфекционного агента.
Механизмы защиты бронхолегочной системы действуют на уровне проводящих и респираторных отделов и осуществляются за счет конденсирования воздуха, механической очистки, эндоцитоза бронхиальным эндотелием, путем клеточной неспецифической защиты.
Неповрежденная слизистая оболочка полости рта, носоглотки и верхних дыхательных путей является непроницаемым барьером для МБТ. Здесь осуществляются механическая очистка воздуха за счет фильтрации и осаждения инородных частиц, удаление их вследствие чихания и кашля. Наиболее значимой частью механической очистки является мукоцилиарный клиренс на уровне бронхов и бронхиол. Клиренс обеспечивается секретом, содержащий лизоцим, протеазы, сурфактант, иммуноглобулин A (IgA), которые опсонируют МБТ, и движением ресничек бронхиального эпителия выводят их из организма.
Нарушение целости слизистой оболочки полости рта и носоглотки, кариозные зубы, автозный стоматит, парадонтоз, синусит, хронический тонзиллит, а также периоды возрастной смены зубов у детей могут являться входными воротами для туберкулезной инфекции.
В трахее и крупных бронхах МБТ, как правило, не задерживаются и оседают в нижних дыхательных путях и альвеолах. Некоторая часть микобактерий остается на месте проникновения, другая с током лимфы и крови переносится к месту внедрения — в региональные лимфатические узлы. В зависимости от локализации входных ворот инфекции могут поражаться подчелюстные, шейные, над- и подключичные, подмышечные внутригрудные и другие региональные лимфатические узлы. В лимфатических узлах МБТ взаимодействуют с клетками иммунной системы, вызывая целый каскад реакций, ведущих к иммунологической перестройке организма к туберкулезной инфекции и формированию специфического клеточного иммунитета.
Локальные изменения в месте внедрения МБТ обусловлены прежде всего неспецифической реакцией полинуклеарных клеток (нейтрофилы), которые фагоцитируют возбудитель. Фагоцитоз является единственным естественным механизмом уничтожения МБТ в организме человека.
Под влиянием токсинов МБТ нейтрофилы разрушаются, вызывая воспалительную реакцию, которая сменяется более совершенной защитной реакцией с участием макрофагов, осуществляющих фагоцитоз и разрушение возбудителя. От активности фагоцитоза во многом зависит эффективность всей системы противотуберкулезной защиты организма. Макрофаги в очаге воспаления принимают форму эпителиоидных клеток, которые сливаются вместе, образуют гигантские клетки, однако при туберкулезе самостоятельно макрофаги уничтожить МБТ не могут. Необходимо активирующее воздействие на них сенсибилизированных клеток, в частности субпопуляции Т-хелперов (CD4+ клетки) и Т-супрессоров (CD8+ клетки).
Важный антимикробный механизм активированных макрофагов, направленный против внутриклеточных возбудителей, связан с цитотоксическим действием L-аргинина. Цитотоксический эффект этого механизма опосредован оксидом азота (NO).
источник
ОБЩАЯ ФТИЗИАТРИЯ
Туберкулез — инфекционное заболевание, поражающее людей и животных, вызываемое микобактериями туберкулеза (МБТ), с преимущественно аэрогенным путем передачи возбудителя и респираторным заражением, при котором развивается специфическое гранулематозное воспаление в легких, а при лимфогематогенном распространении МБТ могут также поражаться ткани практически всех органов организма.(Мишин,2015).
Возбудитель относится к классу— Актинобактерии, порядку— Актиномицеты, семейству— Mycobacteriaceae, роду-Mycobacterium.
По роли в патологии выделяют группы представителей рода микобактерий:
Группа облигатных паразитов среди микобактерий численно незначительна и представлена 8 видами, которые при попадании в ткани организма человека вызывают воспаление в виде специфической туберкулезной гранулемы и образуют группу Mycobacterium tuberculosis complex.
I. Туберкулезные микобактерий (типичные штаммы):
1) М. tuberculosis humanus (M. tuberculosis) — человеческий вид, вызывающий 85—90% всех заболеваний туберкулезом у людей.
2)
М. tuberculosis bovines (M. bovis) — бычий вид, вызывающий 10—15% заболеваний у людей (исходно устойчивый к противотуберкулезному препарату пиразинамиду).
3)
М. tuberculosis bovines BCG (M. bovis BCG) — вид вакцинного штамма
4)
М. tuberculosis africanus (M. africanus — африканский вид, вызывающий до 90% заболеваний у населения Южной Африки (исходно устойчивый к противотуберкулезному препарату тиоацетазону).
5)
М. tuberculosis microti (M. microti) — мышиный вид, вызывающий заболевание у полевых мышей и редко у человека.
6)
М. tuberculosis typhus canettii (M. canettii) — вид, вызывающий заболевание у собак и редко у человека.
7)
М. tuberculosis typhus caprae (M. caprae) — вид, вызывающий заболевание у диких млекопитающих (волки, лисы и др.) и редко у человека.
8)
М. tuberculosis typhus pinnipedii (M. pinnipedii) — вид, вызывающий заболевание у морских млекопитающих (тюленей) и редко у человека.
II. Атипичные штаммы — вызывают микобактериозы:
1. фотохромогенные — микобактерий, синтезирующие пигмент на свету (М. kansassi, M. marinum);
2. скотохромогенные — микобактерий, синтезирующие пигмент в темноте (М. gordonae);
3. ахромогенные — микобактерий, не синтезирующие пигмент (М. avium, M. intracellulare ,M. xenopi);
4. быстрорастущие микобактерий ( M. smegmatis).
Микобактерио́з (лат. mycobacteriosis) — инфекционное заболевание человека и животных, возбудителями которого являются представители большой группы нетуберкулёзных микобактерий (НТМБ).
NB: Латинский префикс «myco-» означает как гриб, так и воск; в данном случае понятие отражает «воскоподобные» компоненты, составляющие часть клеточной стенки микобактериальных клеток.
Основные видовые признаки МБТ — патогенность и вирулентность.
1) Патогенность — способность возбудителя жить и размножаться в тканях живого организма и вызывать специфические ответные гранулематозные морфологические реакции, приводящие к определенной специфической нозологической форме патологии — туберкулезу.
2) Вирулентность — проявляется прежде всего в интенсивности размножения возбудителя и его активности вызывать специфическое поражение в тканях и органах макроорганизма, а также иммунологические реакции и формировать специфический иммунитет.
Особое значение для жизнедеятельности МБТ играет корд-фактор, или фактор вирулентности, расположенный в клеточной стенке в виде монослоя и состоящий на 70% из миколевой кислоты и на 30% из трегалазы. С ним связывают устойчивость МБТ к воздействию растворами кислот, щелочей и спирта, а также развитие воспалительных и некротических изменений в клетках и тканях органов(патогенность).
Также существуют нетуберкулёзные микобактерии(НТМБ), их около 50-ти видов.
По своим морфологическим свойствам они не отличаются от МБТ, но являются самостоятельными видами микобактерии. НТМБ широко распространены в окружающей среде, что служит источником инфекции для человека. НТМБ — потенциальные возбудители заболевания, которое получило название микобактериоз (вследствие естественной устойчивости этих микобактерии к большинству противотуберкулезных препаратов). Лечение микобактериозов вызывает определенные трудности.
Важность инфицирования организма человека некоторыми видами НТМБ в настоящее время определяется тем, что их генетическая структура соответствует таковой у М. bovis BCG и имеется перекрестная чувствительность при внутрикожной пробе с препаратом диаскинтест.
В настоящее время по классификации Runyon (Раньен) (1959) выделяют 4 группы нетуберкулезных микобактерии.
Первые три группы отличаются тем, что они медленно (в течение 1—12 нед) растут на питательных средах, а четвертая — в течение 3—5 дней.
1) Группа 1 — фотохромогенные, образующие пигмент после экспозиции на свету. К ним относят М. kansasii, M. marinum, M. simiae.
2) Группа 2 — скотохромогенные, образующие пигмент желто-оранжевого цвета в темноте. Это самая большая группа среди НТМБ (60—70%). К ним относят М. scrofulaceum, M. xnopi, M. szulgal, М. gordone, M. aquae.
3) Группа 3 — нефотохромогенные, не образующие пигмент. К ним относят М. aviuv complex (1VIAC — М. avium, M. inracellulare, M. paratuberculosis и М. silvaticum), M. bathey, M. malmoense, M. ulcerans, , M. smegmatis, M. nonchromogenicum.
4) Группа 4 — быстрорастущие (в течение 3—5 дней). К ним относят M.fortuitum complex (M.fortuitum и М. chelonae), M. abscessus.
Микобактерио́з (лат. mycobacteriosis) — инфекционное заболевание человека и животных, возбудителями которого являются представители большой группы нетуберкулёзных микобактерий (НТМБ). (ОПИСАНО В 3 ВОПРОСЕ).
Дифференцировать микобактериоз и туберкулез легких бывает весьма сложно, поскольку оба заболевания по клинической картине и рентгенологически, по патоморфологическим изменениям в легких мало чем различаются.
При микобактериозе легких возбудителем заболевания являются ассоциация М. avium-intracellulare, М. skrofuloceum, М. kansasii, М. fortuitum и реже другие.
Клиническая картина и течение микобактериоза во многом определяются видом возбудителя. Начало заболевания может быть острым, подострым и хроническим малосимптомным, т. е. таким же, как и при туберкулезе.
Острые формы возникают с высокой лихорадкой, выраженными симптомами интоксикации, болями в груди, сухим кашлем, кровохарканьем. Хронические формы протекают под маской хронического бронхита с незначительными (или отсутствием) симптомами интоксикации.
Рентгенологически в легких у больных микобактериозом при остром и подостром течении обнаруживаются инфильтраты с распадом, гематогенная диссеминация или кавернозный и фиброзно-кавернозный процессы. При инапперцептном течении характерно формирование осумкованных фокусов (туберкулем), пневмофиброза.
Возможна внелегочная локализация микобактериоза. Поражение внутригрудных или периферических лимфатических узлов (чаще у детей) необходимо дифференцировать от туберкулезной аденопатии.
Иногда развивается генерализованный микобактериоз в виде милиарного процесса по типу милиарного туберкулеза легких, туберкулезного менингита, которые нередко имеют смертельный исход. Одним из наиболее частых возбудителей поражения легких у больных СПИДом являются атипичные микобактерии, которые приобретают выраженную патогенность. Заболевание характеризуется прогрессирующим течением и нередко заканчивается летальным исходом.
Диагноз микобактериоза ставится на основании обнаружения в мокроте или других выделениях атипичных микобактерий и положительной реакции на сенситин (фильтрат из убитых атипичных микобактерий), а основанием для дифференциальной диагностики туберкулеза и микобактериоза является отсутствие эффекта при лечении такими противотуберкулезными препаратами, как стрептомицин и изониазид.
В состав микобактериальной клетки входят вода (85,9%), белки, углеводы, липиды и минеральные соли. Липиды составляют 10—40% сухого вещества.
Белки состоят из туберкулопротеинов, что составляет 56% сухого вещества МБТ. В их состав входят почти все известные аминокислоты. Минеральные вещества — кальций, фосфор, магний, калий, железо, цинк и марганец — в виде различных соединений составляют около 6%.
Отличительные свойства МБТ — кислото- и спиртоустойчивость. Это обусловлено высоким содержанием в клеточных стенках микобактерий миколевой кислоты (С88Н17604), липидов и восков.
Особое значение для жизнедеятельности МБТ играет корд-фактор, или фактор вирулентности, расположенный в клеточной стенке в виде монослоя и состоящий на 70% из миколевой кислоты и на 30% из трегалазы. С ним связывают устойчивость МБТ к воздействию растворами кислот, щелочей и спирта, а также развитие воспалительных и некротических изменений в клетках и тканях органов.
МБТ — грамположительные прямые или слегка изогнутые неподвижные палочки, патогенные для человека и многих видов животных. Наиболее восприимчивы к заражению морские свинки.
Микрокапсула состоит из полисахаридов и играет важную роль в жизнедеятельности МБТ, в том числе придает им устойчивость к неблагоприятным воздействиям внешней среды. Толстая клеточная стенка, насыщенная липидами, ограничивает клетку снаружи, обеспечивая механическую и осмотическую защиту .
Клеточная стенка МБТ состоит из четырех слоев. Первый (внутренний) слой образован пептидогликаном; последующие слои включают миколевые кислоты, гликолипиды, воск и корд-фактор (фактор вирулентности), которые обусловливают склеивание МБТ и оказывают токсическое действие на макрофаги при фагоцитозе. Также это обусловливает гидрофобность МБТ.
В состав цитоплазматической мембраны входят липопротеидные комплексы. С мембраной связаны ферментные системы. В цитоплазме в большом количестве содержаться рибосомы, на которых синтезируется специфический белок.
Для нормального развития МБТ нуждаются в кислороде, поэтому их относят к аэробам. Потребление кислорода микробной клеткой связано с окислительно-восстановительными процессами и высоким уровнем синтеза аденозинтрифосфорной кислоты (АТФ) в МВТ. При формировании гранулем размножение МВТ замедляется из-за снижения в них парциального давления кислорода. Однако имеются сведения о том, что некоторые виды МВТ можно рассматривать как факультативные анаэробы.
Размножение МВТ происходит путем простого деления клетки. Цикл простого деления материнской клетки на две дочерние занимает от 13—14 до 18—24 ч. Микроскопически видимый рост микроколоний на жидких средах можно обнаружить на 5—7-й день, видимый рост колоний на поверхности твердой среды — на 12—20-й день.
Известен более сложный цикл деления — почкование.На одном из полюсов клетки образуется выпуклость, она переходит в шаровидную структуру, которая отпочковывается от материнской клетки, и в ней происходит образование обычных кислотоустойчивых палочек. Весь цикл размножения и воспроизводства продолжается примерно 7—9 сут.
Существует ещё один способ размножения МБТ — спорообразование, что роднит их с актиномицетами. В клетке образуются зёрна, которые выходят наружу и из них формируются обычные палочки. Образование спор происходит в латентной фазе роста возбудителя.
В 1998 г. полностью расшифрован геном МВТ. Он имеет длину 4 411 529 пар нуклеотидов. Для МВТ имеются уникальные гены, в частности гены mtp40 и трЬ70, которые применяются для выявления МВТ с помощью полимеразно-цепной реакции (ПЦР). Расшифровка геномов разных видов микобактерий позволила выделить в геноме комплекса МБТ уникальную область — RD1
В 1998 г. полностью расшифрован геном МВТ. Он имеет длину 4 411 529 пар нуклеотидов, которые почти в 70% представлены гуанином и цитозином.
Для МВТ имеются уникальные гены, в частности гены mtp40 и mpb70, которые применяются для выявления МВТ с помощью полимеразноцепной реакции (ПЦР).
Геном МБТ радикально не отличается от других видов микобактерий. Большая часть генов обеспечивает синтез клеточной стенки и фактора вирулентности(корд-фактор).
Тождественность дезоксирибонуклеиновой кислоты (ДНК) комплекса МБТ (М. tuberculosis, M. bovis, M. bovis BCG, M. africanum, M. microti, М. Canettii, М. саргае и М. pinnipedii) составляет 99,9%.
Расшифровка геномов разных видов микобактерий позволила выделить в геноме комплекса МБТ уникальную область — RD1 В области RD1 кодируется синтез двух секреторных белков: ESAT-6 , CFP-10. Белки ESAT-6 и CFP-10 определяют скорость размножения МБТ, степень вирулентных свойств и массивность развития специфических изменений в органах. При этом белок ESAT-6 проявляет усиливающие свойства в комплексе ESAT-6—CFP-10, который формирует длительный постинфекционный иммунный ответ. В то же время область RD1 отсутствует не только у М. bovis BCG и М. bovis, у целой группы НТМБ(20 видов). При этом отсутствие области RD1, а следовательно, отсутствие возможности синтеза секреторных белков (ESAT-6 и CFP-10) M. bovis BCG позволяет проводить диагностику инфекционной и послевакцинной чувствительности к туберкулину у детей и подростков. Однако при отсутствии области RD1 у большого числа НТМБ, широко распространенных во внешней среде, могут возникать существенные трудности в диагностике, особенно в регионах, где распространены данные микобактерий. На основании этих белков в Российской Федерации разработан препарат диаскинтест, который при внутрикожной пробе позволяет проводить дифференциальную диагностику поствакцинной и инфекционной аллергии у детей и подростков. Видоспецифические антигены МВТ находятся в клеточной стенке. Они вызывают в организме развитие реакций клеточного иммунитета и антителообразование. Антигенными свойствами обладают белки, полисахариды и липиды. Такие антигены могут быть получены как из фильтратов культур, так и из разрушенных разными способами микобактериальных клеток. Также используются методы генной инженерии. Благодаря клеточной стенке и своим формам размножения МБТ обладают значительной устойчивостью к неблагоприятным воздействиям внешних физических и химических агентов, холоду, теплу, влаге и свету. В естественных условиях при отсутствии солнечного света МБТ могут сохранять свою жизненную способность в течение нескольких месяцев. В высохшей мокроте они могут оставаться живыми до 1 — 1,5 лет (в жилом помещении), на страницах книг — до 10 мес. В почве и воде МБТ остаются жизнеспособными около года, в уличной пыли — около месяца. Они выдерживают процессы гниения и могут в течение 3—6 мес оставаться живыми в погребенных трупах. В сыром молоке МБТ выживают 14—18 дней, скисание и пастеризация молока не ведут к их гибели. В масле и сыре МБТ не погибают в течение 8— 12 мес. При прогревании молока они выдерживают нагревание при температуре 55—60 °С в течение 60 мин, нагревание при 70 °С — в течение 20 мин; Лиофилизированные и замороженные МБТ сохраняют жизнеспособность 30 лет и более. Сухой жар при 100 °С оказывает губительное действие в течение 60 мин. Особо высокой устойчивостью во внешней среде обладают формы МБТ в виде спор, сохраняющих жизнеспособность и способность превращения в типичные клеточные формы в течение длительного времени. Культура МБТ, облученная солнечным светом, погибает в течение 1,5 ч. Ультрафиолетовые лучи убивают их через 2—3 мин. При кипячении МБТ во влажной мокроте погибают в течение 5 мин, а в высушенной мокроте — только через 45 мин. МБТ довольно устойчивы к действию ионизирующей радиации. Так, 36-часовое облучение рентгеновскими лучами культуры МБТ на питательной среде слабо действует на ее жизнеспособность. Ультразвуковые волны разрушают МБТ; они теряют способность размножаться под действием электромагнитных волн с частотой колебаний 2000 кГц. Обычные дезинфекционные агенты слабо эффективны в отношении МБТ. Они устойчивы к кислотам, щелочам, спирту. Слабые растворы серной кислоты или 10—15% гидроксид натрия не убивают МБТ в течение 30 мин. Однако более длительное воздействие концентрированных растворов кислот оказывается для них губительным. 5% карболовая кислота и 5% формалин убивают МБТ в мокроте в течение 24 ч. Надежной дезинфекции мокроты больных туберкулезом можно добиться при применении препаратов йода и хлора, обладающих высоким бактерицидным действием на МБТ. 2% раствор хлорной извести убивает МБТ в течение 24—48 ч. Более высокие концентрации препаратов хлора — 3—5% раствор хлорамина и 10—20% раствор хлорной извести — вызывают их гибель в течение нескольких часов. ВОПРОС 11. ИЗМЕНЧИВОСТЬ МИКОБАКТЕРИИ ТУБЕРКУЛЕЗА Одним из характерных свойств МБТ является их способность изменяться под воздействием внешних факторов. Полиморфизм возбудителя проявляется в образовании нитевидных цетных, кокковидных и лекарственно-устойчивых форм. Другой формой клеточного полиморфизма является образование, обусловленное утратой плотной клеточной стенки и образованием сферопластов, окруженных цитоплазматической мембраной, сходной с мембраной клеток макроорганизма. В связи с такой перестройкой меняется не только морфология МБТ, но и антигенный состав, и степень патогенности для человека и животных. L-формы МБТ устойчивы к большинству противотуберкулезных препаратов и характеризуются резко сниженным уровнем метаболизма и ослабленной вирулентностью. L-формы могут длительное время персистировать в организме и поддерживать противотуберкулезный иммунитет. При снижении иммунореактивности организма они способны активизироваться, превращаться в типичные микобактерии, вызывая реактивацию специфического процесса. Выявлен ген, участвующий в превращении типичных МБТ в L-формы. МБТ могут также существовать в виде ультрамелких фильтрующихся форм, представляющих собой частицы (0,22—0,24 мкм) округлой формы, некоторые из них окружены плотной клеточной стенкой. Таким образом, при неблагоприятном изменении каких-либо параметров среды обитания МБТ утрачивают клеточную стенку и трансформируются в обладающие повышенной устойчивостью к вредным воздействиям — гипоксии, действию противотуберкулезных препаратов и др. Они приобретают способность долго сохраняться и даже размножаться почкованием в виде зернистых различной величины шаров. При длительном неблагоприятном воздействии (например, продолжительный курс химиотерапии) зернистые шары могут распадаться на мельчайшие некислотоустойчивые фильтрующиеся формы. При исключении неблагоприятных факторов фильтрующиеся и формы реверсируются в классическую палочковидную форму. источник Изменчивость– это способность микроорганизма изменятся под воздействием внешних факторов. Изменение среды паразитирования приводит к появлению у микобактерий при-способительных реакций, изменению их метаболизма, повышению частоты му-таций и генетических рекомбинаций. Различные формы изменчивости (транс-формации) преследуют определенную цель — выживание микобактерий при неблагоприятных условиях, сохранение способности к «персистированию». Виды изменчивости микобактерий: а) морфологическая изменчивость — изменчивость формы бактерии (образо-вание гигантских форм с колбовидно утолщенными разветвлениями, ните-видных, мицелиеподобных, булавидных, зернистых, дифтероидных); б) тинкториальная изменчивость — изменчивость по отношению к красящим веществам (изменение степени кислотоустойчивости); в) культурная изменчивость — изменчивость морфологии и цвета культур при росте на искусственных питательных средах; г) биологическая изменчивость — изменение степени вирулентности в сторону повышения или понижения, вплоть до полной утраты вирулентности (L-формы, фильрующиеся вирусоподобные формы); L — формы– пребациллярные, некислотоустойчивые варианты МБТ, имеющие дефекты клеточной стенки. Обнаружено, что трансформация МБТ в L-формы усиливается под влиянием длительной антибактериальной терапии, поверхностно-активных веществ и микобактериофагов, которые нарушают их рост и размножение, образование клеточной мембраны. При этом происходят глубокие морфологические и функциональные изменения клеток, которые при-водят к возникновению протопластов, сферопластов, нестабильных или стабильных L- форм, характеризующихся сниженным уровнем метаболизма, ослабленной вирулентностью. Оставаясь жизнеспособными, они могут длитель-ное время оставаться в организме и индуцировать противотуберкулезный иммунитет. Установлено, что в мокроте «абациллярных» больных с деструктив-ными формами туберкулеза могут находиться L-формы МБТ, способные, при соответствующих условиях, ревер-сировать (модифицироваться) в палочковид-ный вариант. L- формы отличаются от исходных микобактерий нечувствитель-ностью к противотуберкулезным препаратам, спровоцировавшим их появление. Они обладают свойством проходить через гистогематическим барьер и быстро распространяться в организме, вызывая гематогенную генерализацию процесса. У больных туберкулезом в процессе антибактериальной терапии происходит уменьшение числа бактериальных форм возбудителя и нарастает количество L- вариантов, которые чаще обнаруживают у больных с незаметным началом и медленным развитием туберкулеза. Доказана также возможность персистенции L- форм у практически здоровых инфицированных лиц, особенно при остаточ-ных туберкулезных изменениях. При вакцинации детей также возникает интен-сивная ранняя (через 2 недели после введения) L- трансформация микобактерий БЦЖ, которые способны длительно сохраняться в организме ребенка. Описаны случаи внутриутробного заражения плода L- формами микобактерий тубер-кулеза, которые реверсируют в вирулентные микобактерии и вызывают генера-лизованный туберкулезный процесс. Тинкториальная изменчивость (кислотоустойчивость). Свойство кислотоустойчивости микобактерий не является постоянным. Потеря кислотоустойчивости возникает при изменении процессов внутриклеточного обмена, приводящих к частичной деструкции клеточной стенки. Изменение сте-пени кислотоустойчивости наблюдали в основном при неблагоприятных для микобактерий условиях: при изменении состава питательной среды, действии пенициллина, ультрафиолетового облучения и других факторов. Некислотоустойчивые культуры состоят из полиморфных палочек или кокков, часто расположенных парами и окруженных слизистой массой. В отличие от кислотоустойчивых микобактерий они быстро растут на питательных средах (2 – 3 дня), при длительном культивировании на яичных средах отмечена их реверсия в кислотоустойчивые палочки. При заражении некислотоустойчивыми культурами морских свинок возникает хроническое заболевание с параспеци-фическими реакциями в виде инфильтраций из лимфоидно-эпителиоидных кле-ток в легких и других органах, гиперплазии лимфатических узлов и селезенки. Важным является выделение некислотоустойчивых форм из крови больных туберкулезом легких и из закрытых очагов костного туберкулеза. Антигенная структура этих форм показывает содержание у них антигенов как типоспецифи-ческих, так и общих с кислотоустойчивыми туберкулезными палочками. источник Возникновение и течение туберкулеза зависят от особенностей его возбудителя, реактивности организма и санитарно-бытовых условий. Современное название возбудителя — микобактерия туберкулеза. Старое название — бактерия Коха (БК). 24 марта 1882 Р. Кох продемонстрировал чистую культуру возбудителя под микроскопом, также он доказал его инфекционную природу, заразив животных. Поэтому микроб назван его именем. Следует отметить, что 18 марта 1882 Баумгартен, также немецкий ученый, показал палочку туберкулеза, выделенную из органов кролика, пораженного туберкулезом, но только под микроскопом. Возбудитель туберкулеза относится к роду микобактерий, семьи актиномицетов и класса шизомицетив. К роду микобактерий относятся также возбудитель лепры и группа сапрофитов, которые встречаются в выделении из ушей, в мокроте при бронхоэктазах, а также кислотоустойчивые микроорганизмы, вегетирующие на слизистых оболочках человека, в сливочном масле, молоке, на растениях, в воде, почве и т. д. По патогенности для человека и для отдельных видов микобактерии делятся на 2 группы. Первая группа — собственно патогенные микобактерии туберкулеза, среди которых выделяют три вида. Вторая группа — атипичные микобактерии, среди которых есть сапрофиты — не патогенные для людей и животных и условно патогенные микобактерии — при некоторых условиях могут вызвать микобактериоз, который напоминает туберкулез. По одной из классификаций они разделены на четыре группы (в зависимости от скорости роста и пигментообразования). Атипичные микобактерии определяются в 0,3-3% культур, чаще вследствие загрязнения среды. Этиологическая роль их считается доказанной, если из патологического материала они высеваются повторно и их рост характеризуется большим количеством колоний, а других возбудителей заболевания нет. Заболевание, вызванное атипичными штаммами микобактерий туберкулеза, называют микобактериозом. Из штаммов атипичных микобактерий получен продукт их жизнедеятельности — сенситин. При внутрикожном введении сенситина у больных микобактериозом возникает положительная реакция. По клиническому течению микобактериоз напоминает туберкулез, иногда сопровождается кровохарканьем, быстро прогрессирует. Различают три типа микобактериоза, которые зависят от вида микобактерий и иммунного статуса организма: 1. Генерализованная инфекция с развитием видимых невооруженным глазом патологических изменений внешне напоминают туберкулезные, но гистологически несколько отличаются от них. В легких обнаруживают диффузные интерстициальные изменения без гранулем и полостей распада. Основными признаками являются повышение температуры тела, двусторонняя диссеминация в средних и нижних отделах легких, анемия, нейтропения, хроническая диарея и боль в животе. Диагноз подтверждается нахождением возбудителя в мокроте, кале или биопсией. Эффективность лечения низкая, смертность высокая и достигает 20%. Эффективными для лечения при микобактериоза является циклосерин, этамбутол, канамицин, рифампицин и частично стрептомицин. 2. Локализованная инфекция — характеризуется наличием макро- и микроскопических поражений, выявляемых в определенных участках тела. 3. Инфекция, которая протекает без развития видимых поражений; возбудитель находится в лимфатических узлах. Туберкулез у людей преимущественно (95-97%) возникает вследствие заражения человеческим, реже (3-5%) бычьим и казуистически — птичьим видом микобактерий туберкулеза. М. africanum вызывает туберкулез у людей в странах Тропической Африки. Микобактерии туберкулеза имеют форму тонких, длинных или коротких, прямых или искривленных палочек, длиной 1,0-4,0 мкм и диаметром 0,3-0,6 мкм; неподвижные, спор и капсул не образуют, грамположительные, имеют большой полиморфизм. Микобактерии туберкулеза человеческого вида более тонкие и длинные, чем бычьего. Микобактерии бычьего вида менее патогенны для людей, и заболевание, вызванное ими, встречается значительно реже. Для определения МБТ человеческого вида применяют ниациновий тест. Он базируется т том, что МБТ этого вида выделяют больше ниацина (никотиновой кислоты). Молодые бактерии гомогенные, в процессе их старения образуется зернистость (зерна Муха), которая более подробно изучается методом электронной микроскопии. Зернистая форма микобактерий туберкулеза образуется также под влиянием антимикобактериальных препаратов. После введения зерен животным у них возникает кахексия, увеличение лимфатических узлов или заболевания туберкулезом с развитием типичных штаммов микобактерий туберкулеза. Описанные оскольчатые формы микобактерий туберкулеза. Возбудитель туберкулеза может существовать также в виде фильтрующихся форм. Под влиянием противотуберкулезных препаратов морфологические и физико-химические свойства микобактерий туберкулеза изменяются. Микобактерии становятся короткими, приближаясь к кокобацилам, их кислотостойкость уменьшается, поэтому при окраске по Цил-Нильсену они обесцвечиваются и не определяются. Микобактерии туберкулеза размножаются поперечным делением, ветвлением или отпочкование отдельных зерен. Микобактерии туберкулеза растут на питательных средах при наличии кислорода. Но они являются факультативными аэробами, т.е. растут и когда доступа воздух не имеет — кислород они получают из углеводов. Поэтому для выращивания микобактерий требуется питательная среда, богатая углеводами. Эффективны плотные среды, в состав которых входят яйца, молоко, картофель, глицерин. Чаще применяют среды Левенштейна-Иенсена, Гельберга, Финна-2, Миддлбрука, Огава. Добавление желчи в питательную среду замедляет их рост. Это обстоятельство использовали Кальметт и Герен при разработке вакцины. На жидких питательных средах с добавлением глицерина микобактерии туберкулеза растут в виде пленки. Колонии микобактерий могут быть шероховатыми (К.-варианты) и реже — гладкими, сливающимися между собой (8-варианты). К.-варианты микобактерий вирулентные для людей и животных, а 8-варианты чаще невирулентные. Микобактерия состоит из клеточной оболочки и цитоплазмы. Клеточная оболочка трехслойная и состоит из наружного, среднего и внутреннего слоев. В вирулентных микобактерий она имеет толщину 230-250 нм. Внешний слой, окружающий клетку, называют микрокапсулой. Она образована полисахаридами и содержит фибриллы. Микрокапсула может окружать целый популяцию микобактерий, а также помещаться на местах прилегания микобактерий друг к другу. Отсутствие или наличие роста, его интенсивность и состав микрокапсулы зависят от того, какое количество корд-фактора экстрагируется из цитоплазмы в клеточную стенку. Чем больше корд-фактора экстрагируется, тем лучше выражена микрокапсула у микобактерий туберкулеза. Клеточная оболочка участвует в регуляции метаболических процессов. В ней содержатся видоспецифические антигены, благодаря чему клеточная стенка является локусом, где происходят аллергические реакции повышенной чувствительности замедленного типа и образование антител, поскольку она, как собственно поверхностная структура бактериальной клетки, первой контактирует с тканями макроорганизма. Под клеточной оболочкой расположена трехслойная цитоплазматическая мембрана, тесно прилегает к цитоплазме. Она состоит из липопротеидных комплексов. В ней происходят процессы, обусловливающие специфичность реакции микобактерий на факторы окружающей среды. Цитоплазматическая мембрана микобактерий туберкулеза путем своей центростремительной инвагинации формирует в цитоплазме внутрицитоплазматическая мембранную систему — мезос. Мезосомы — полуфункциональные структуры. В них содержится много ферментных систем. Они участвуют в синтезе и формировании клеточной стенки и выполняют роль посредника между ядром и цитоплазмой бактериальной клетки. Цитоплазма микобактерий состоит из гранул и включений. У молодых микобактерии туберкулеза цитоплазма более гомогенная и компактная, чем у старых, у которых в цитоплазме больше вакуоль и полостей. Основную массу гранулярных включений составляют рибосомы, располагающиеся в цитоплазме в свободном состоянии или образующие полисомы — скопление рибосом. Рибосомы состоят из РНК и белка и синтезируют специфический белок. Иммуногенность микобактерий туберкулеза обусловлена в основном антигенными комплексами, содержащихся в оболочках микобактериальных клеток. Рибосомы, рибосомный белок и цитоплазма микобактерий имеют антигенную активностью в реакциях замедленного типа. Химический состав микобактерий туберкулеза изучен достаточно хорошо. Они содержат 80% воды и 2-3% золы. Сухой остаток наполовину состоит из белков, преимущественно туберкулопротеинов, липидов — от 8 до 40%, столько же полисахаридов. Предполагают, что туберкулопротеины являются полноценными антигенами и могут вызывать у животных состояние анафилаксии. Липидная фракция приводит резистентность возбудителя туберкулеза, а полисахаридная участвует в иммуногенезе. Туберкулопротеины и липидные фракции обусловливают токсичность микобактерий туберкулеза, которая присуща не только живым, но и убитым микроорганизмам. Выявлено три фракции липидов: фосфатидная, жировая и восковая. Большое содержание липидов отличает микобактерии туберкулеза от других видов микроорганизмов и приводит следующие свойства: 1. Устойчивость к кислотам, щелочам и спиртам (преимущественно обусловлено наличием миколевой кислоты). 2. Устойчивость против обычных дезинфицирующих веществ. 3. Патогенность туберкулезных микобактерий. Экзотоксины не определены, но сами клетки микобактерий токсичные — приводят к частичному или полному распаду лейкоцитов. В неорганическом остатке микобактерий туберкулеза определяют соли железа, магния, марганца, калия, натрия, кобальта. Антигенная структура микобактерий сложная и еще не в совершенстве изучена. Микобактерии имеют специфические видовые и межвидовые и даже межродовые антигенные связи. В отдельных штаммах выявлены различные антигены. Однако все без исключения микобактерии содержат вещества, устойчивые к нагреванию и воздействию протеолитических ферментов — полисахариды, которые являются общим антигеном. Кроме того, различные виды микобактерий имеют свои специфические антигены. А. П. Лысенко (1987) доказал, что все штаммы M. bovis имеют идентичный антигенный спектр с 8 антигенов, из которых 5-6 были общеродовыми и реагировали с антисыворотками к микобактерий других видов: 6 — с M. tuberculosis, 3-5 — M. kansasii и т.д. Патогенность — это видовое свойство микобактерий туберкулеза, оказывается возможностью вызвать заболевание. Главным фактором патогенности являются токсические гликолипиды — корд-фактор. Это вещество, которое склеивает вирулентные микобактерии, благодаря чему они растут на питательных средах, в виде жгутов. Корд-фактор обусловливает токсическое действие на ткани и защищает туберкулезные палочки от фагоцитоза, блокируя окислительное фосфорилирование в митохондриях макрофагов. Поэтому, поглощены фагоцитами, они размножаются в них и вызывают их гибель. Кислотостойкие сапрофиты не образуют корд-фактора. Вирулентность — степень патогенности; возможность роста и размножения микобактерий в определенном макроорганизме и способность вызывать специфические патологические изменения в органах. Вирулентным считают штамм микобактерий в том случае, когда он в дозе 0,1 0,01 мг вызывает заболевания туберкулезом, а через 2 месяца — смерть гвинейской свинки массой 250-300 г. Когда после введения этой дозы животное умирает через 5 6 месяцев, то этот штамм считают слабовирулентным. Вирулентность не является неизменным свойством микобактерий. Она снижается при старении культуры или выращивание на искусственных питательных средах и в процессе лечения больных. При пассажах на животных или в случаях обострения туберкулезного процесса вирулентность возрастает. Носителями генетической информации микобактерий туберкулеза являются хромосомы и внехромосомные элементы — плазмиды. Главное отличие между хромосомами и плазмидами заключается в их размерах. Плазмида сравнению с хромосомой значительно меньше и поэтому несет меньшее количество генетической информации. Именно благодаря своим малым размерам плазмида хорошо приспособлена к перенесению генетической информации из одной микобактериальной клетки в другую. Плазмиды могут взаимодействовать с хромосомой. Гены устойчивости микобактерий туберкулеза против химиопрепаратов локализуются и в хромосомах, и в плазмидах. У микобактерии есть ДНК, которая функционирует как главный носитель генетической информации. Последовательность нуклеотидов в молекуле ДНК — это ген. Генетическая информация, которую несет ДНК, не является чем стабильным и неизменным. Она изменчива и эволюционирует, совершенствуясь. Единичные мутации обычно не сопровождаются большими изменениями информации, заложенной в геноме. С одного штамма может возникнуть несколько различных фенотипов (или признаков, проявляющихся в результате действия генов в определенных условиях), которые устойчивы против определенного антимикобактериального препарата. Мутация может проявляться и в изменении морфологии колоний. Так, если изменить вирулентность микобактерий туберкулеза, то может измениться и морфология колоний мутантов. Трансдукция — это перенос генетического материала (частицы ДНК) от одной микобактерии (донора) к другой (реципиенту), что приводит к изменению генотипа микобактерии-реципиента. Трансформация — это включение в хромосому или плазмиду микобактерии (реципиента) фрагмента ДНК другой микобактерии (донора) в результате переноса изолированной ДНК. Конъюгация — это контакт клеток микобактерии туберкулеза, во время которого происходит переход генетического материала (ДНК) из одной клетки в другую. Трансфекция — это воспроизведение вирусной формы микобактерии туберкулеза в клетке, которая инфицирована изолированной вирусной нуклеиновой кислотой. Изложенные гипотетические пути переноса генетической информации еще не изучены. Однако несомненно, что эти генетические процессы являются основой для возникновения лекарственной устойчивости как в отдельных микобактерий, так и у всей бактериальной популяции, имеющейся в организме больного. Изменчивость микобактерий — это свойство их приобретать новые или / и терять старые признаки. В связи с тем, что у микобактерий туберкулеза короткий период генерации, высокая частота мутаций и рекомбинаций, обмена генетической информацией, изменчивость в них весьма высока и частая (Н. А. Васильев и соавт., 1990). Различают фенотипическую и генотипическую изменчивости. Фенотипическую мутацию называют еще модификационной, которой свойственна высокая частота изменений и их частая реверсия в исходную форму, адаптация к изменениям внешней среды отсутствие изменений в генетическом коде. Она наследственно не передается. Генотипическая мутация наступает вследствие мутаций и рекомбинаций. Мутации — это стабильные унаследованные изменения в нуклеотидном составе генома микобактерии включая плазмиды. Они бывают спонтанные и индуцированные. Спонтанные мутации возникают со специфической для данного гена скоростью. Большинство из них являются следствием ошибок в репликации и репарации ДНК. Индуцированные мутации возможны в результате воздействия мутагенов (ультрафиолетовая; ионизирующая радиация, химические вещества и т.п.). Мутации часто приводят к появлению в фенотипе нового признака или потери старой признаки (по сравнению с родительской формой). Рекомбинации генетические — это процесс образования потомства, содержащее признаки донор; и реципиента. Одним из видов изменчивости микобактерий туберкулеза является образование ими фильтрующиеся формы. Это очень мелкие, невидимые при обычной микроскопии формы, имеющие очень слабую вирулентность, их можно обнаружить только при реверсии, используя для этого повторные пассажи на морских свинках. В этих случаях иногда обнаруживают кислотостойкие палочки с очень низкой вирулентностью. Фильтрующиеся формы — это мелкие фрагменты микобактерий туберкулеза, образующиеся в неблагоприятных условиях существования и способны к реверсии. Природа этих форм, их структура, а также значение в патогенезе туберкулеза до сих пор окончательно не установлено. L-формы микобактерий туберкулеза имеют или дефекты или отсутствие клеточной стенки. Для них характерна резко измененная морфология бактериальной клетки и пониженный метаболизм. Они имеют низкую вирулентность и быстро разрушаются в окружающей среде. Из-за отсутствия или повреждения оболочки микобактерий туберкулеза L-формы красят обычными красителями, поэтому их не удается выявить бактериоскопически в мазках. Преобразование микобактерий туберкулеза в L-формы происходит под действием противотуберкулезных препаратов, под воздействием защитных сил макроорганизма и других факторов. L-формы микобактерий туберкулеза могут быть в макроорганизме в стабильном и нестабильном состоянии, то есть реверсировать в исходный микробный вид с восстановлением вирулентности. Вирулентные свойства стабильных L-форм микобактерий резко снижены по сравнению с вирулентностью нестабильных форм. Нестабильные L-формы микобактерий туберкулеза вызывают у морских свинок генерализованный туберкулез, а стабильные L-формы обусловливают лишь морфологические изменения, близкие к вакцинному процессу. Стабильные L-формы микобактерий преимущественно содержатся в неактивных туберкулезных очагах. Эти очаги способствуют возникновению у здоровых инфицированных людей противотуберкулезного иммунитета. Для эффективного лечения больных туберкулезом нужно проводить определение чувствительности возбудителя, потому устойчивость против антимикобактеральных препаратов затрудняют лечение. Обычно в организме больного резистентность микобактерий против лекарственных средств может храниться в течение 1-2 лет после их отмены. Медикаментозная устойчивость микобактерий туберкулеза — это устойчивость МБТ против друга антимикобактериального препарата или более. Первичная медикаментозная устойчивость — устойчивость, обнаруженная у впервые выявленных больных, которые никогда не принимали противотуберкулезные препараты. Начальная медикаментозная устойчивость — устойчивость МБТ, выявленная у впервые выявленных больных, леченных противотуберкулезными препаратами не более 4 недель или у больных при отсутствии данных о предшествующем лечении. Вторичная (приобретенная) медикаментозная устойчивость — резистентность МБТ, обнаружена у больных, которым назначали противотуберкулезные препараты более 4 недели. Монорезистентность — устойчивость МБТ против 1 из 5 препаратов I ряда (изониазиду стрептомицина, рифампицина, этамбутола, пиразинамида). В Украине частота возникновения первичной резистентности возбудителя туберкулеза против препаратов I ряда отмечается в 23-25%, а вторичной — в 55-56% случаев. Множественная лекарственная устойчивость — устойчивость МБТ против двух и больше препаратов. Мультирезистентность — это разновидность множественной лекарственной устойчивости, и именно — устойчивость возбудителя только против комбинации изониазид + рифампицин или и рядом: другими препаратами. Результат определения чувствительности микобактерий туберкулеза к противотуберкулезным препаратам называется антибиограмой. Причины лекарственной устойчивости: 1. Биологические — недостаточная концентрация препарата, индивидуальные особенности организма пациента (скорость инактивации препаратов) 2. Причины, обусловленные пациентом — контакт с больными химиорезистентным туберкулез, нерегулярный прием препаратов, преждевременное прекращение приема лекарств, неудовлетворительная переносимость препаратов, проведение неадекватного лечения. 3. Факторы, обусловленные болезнью — при изменении доз препаратов, при большом количестве МБТ в участках пораженного органа может возникать определенная рН, которая препятствует активному действию лекарств, лечение одним препаратом, недостаточная доза или продолжительность лечения. В последние годы интенсивно проводили генетические исследования штамма М. tuberculosis. Количество гуанинцитозиновых основ, которые распределяются на спирали дезоксирибонуклеиновой кислоты (ДНК), составляет 65,5%. Геном содержит много вставных последовательностей, мультигенных семей, амплифицированных (удвоенных) мест собственного обмена веществ. РНК-молекулы кодируют около 50 генов, в частности: М. tuberculosis имеет 11 рецепторзависимых гистидинкиназ, несколько цитоплазматических киназ и немного генов, участвующих в регуляторных каскадах. В М. tuberculosis является группа эукариотических серинтиреонинових протеинкиназ, отвечающих за фосфорилирование в бактериальной клетке. Для осуществления липидного обмена в М. tuberculosis синтезируются приблизительно 250 ферментов. Окисление жирных кислот обеспечивают такие ферментные системы: 1. РабА / РабВ-Р-оксидазные комплексы. 2. Тридцать шесть ацил-СоА-синтетаз и группа из тридцати шести ацил-СоА-синтетазсвязанных белков. 3. Пять ферментов, завершают цикл окисления (реакция тиолиза 3 кетоэстеров). 4. Четыре гидроксиацил-СоА-дегидрогеназы. 5. Двадцать один вид белков эноил-СоА-гидратазо-изомеразной группы. Патогенность М. tuberculosis обусловлена также такими факторами, как: 3) МСЭ-оперон, кодирующий белки внутриклеточной инвазии; 5) ферменты, продуцирующие компоненты клеточной стенки; 6) гематоглобиноподобные Ре-связующие белки, которые обеспечивают длительное анаэробное существование микобактерий; 8) значительная антигенная лабильность; 9) наличие различных путей обеспечения антибиотикорезистентности; 10) наличие актериоцинов с цитотоксическим действием (некоторые поликетины). Возбудитель туберкулеза устойчив к воздействию факторов окружающей среды. На страницах книги микобактерии сохраняются в течение 2-3 мес, в уличной пыли — около 2 недель, в сыре и масле — от 200 до 250 дней, в сыром молоке — 18 дней (скисания молока не вызывает гибели микобактерий), в комнате с рассеянным дневным светом — 1- 5 мес., а в сырых подвальных помещениях и в помойных ямах — до 6 мес. Оптимальной температурой роста возбудителя является 37-38 ° С, при температуре 42-43 ° С и ниже за 22 ° С рост и размножение его прекращаются. Для птичьего вида микобактерий туберкулеза оптимальной температурой роста является 42 ° С. При температуре 50 ° С микобактерии туберкулеза погибают через 12 ч., 70 ° С — через 1 минуту. В белковой среде их устойчивость значительно повышается. Так, микобактерии туберкулеза в молоке выдерживают температуру 55 ° С в течение 4 ч., 60 ° С — 1 час., 70 ° С — 30 мин., 90 95 ° С — от 3 до 5 минут. Особенно возрастает устойчивость микобактерий туберкулеза в высохшей мокроте. Чтоб обезвредить жидкое мокроты, их нужно кипятить в течение 5 мин. В высохшей мокроте микобактерии туберкулеза погибают при 100 ° С через 45 минут. В тонком слое жидкой мокроты под влиянием ультрафиолетовых лучей микобактерии туберкулеза погибают через 2-3 мин., а в высохшей мокроте и в темном месте они могут сохранять жизнеспособность в течение 6-12 мес. Однако под воздействием прямого или рассеянного солнечного излучения в течение 4 часов высохшие мокроты теряет свойство вызвать заражение животных туберкулезом. В высохшей на солнце мокроте микобактерии туберкулеза не определяются. Если мокрота попадает в сточные воды или на поля орошения, микобактерии туберкулеза сохраняют свою вирулентность более 30 дней. На расстоянии 100 м от места сброса сточных вод с противотуберкулезного санатория микобактерии туберкулеза обнаружить не пришлось. Микобактерии туберкулеза неодинаково устойчивы против воздействия различных дезинфицирующих средств. Так, двойное количество 5% раствора хлорамина убивает микобактерии в мокроте через 6 ч., 2% раствор хлорной извести — через 24-48 ч. источник
Антигенный компонент МБТ, индуцирующий формирование ГЗТ, — белки, а полисахариды и липиды таким действием не обладают. Однако гликолипиды клеточной стенки (мурамиллипептид, димиколат ) обладают мощным адъювантным действием, что широко используется для усиления иммунного ответа на слабоиммуногенные антигены или гаптены, в том числе на туберкулин.
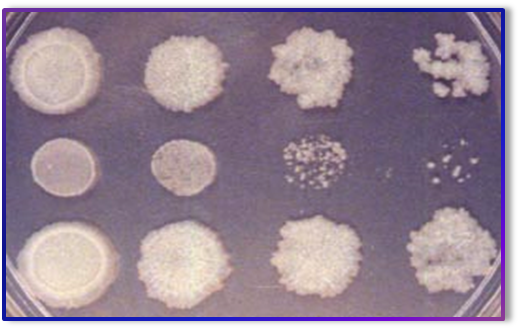
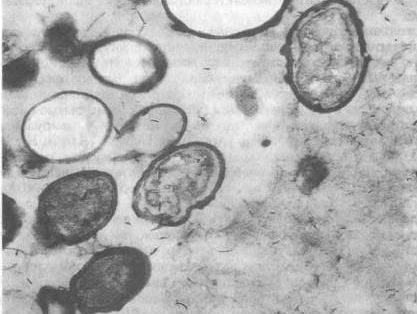
Микобактерии туберкулеза растут медленно. Первые колонии появляются на 12-30-й день, а иногда и через 2 месяца. Для обеспечения роста микобактерий туберкулеза к питательным средам добавляют 3-6% глицерина. Микобактерии лучше растут в слабо-щелочной среде, хотя могут расти и в нейтральной.
1) антиоксидазная каталазная-пероксидазная система;